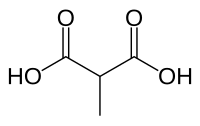
Ácido metilmalônico
| Ácido metilmalônico Alerta sobre risco à saúde | |
|---|---|
| |
| Outros nomes | Methylmalonic acid |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChemSpider | |
| KEGG | |
| MeSH | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C4H6O4/c1-2(3(5)6)4(7)8/h2H,1H3,(H,5,6)(H,7,8)
|
| Propriedades | |
| Fórmula química | C4H6O4 |
| Massa molar | 118.07 g mol-1 |
| Densidade | 1.455 g/cm−3 |
| Ponto de fusão |
134 °C, 407 K, 273 °F |
| Acidez (pKa) | pKa1 = 3,07[1] pKa2 = 5,76[1] |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Acido metilmalônico é um composto químico do grupo dos ácidos dicarboxílicos. É constituído pela estrutura básica do ácido malónico e contém também um grupo metilo. Os sais do ácido metilmalónico são denominados metilmalonatos.
Metabolismo
editarO ácido metilmalónico é um subproduto da via do metabolismo do propionato.[2] As fontes de partida para este produto são as seguintes, com as respectivas contribuições aproximadas para o metabolismo do propionato em todo o organismo entre parêntesis:[3]
- aminoácidos essenciais: metionina, valina, treonina e isoleucina[4] (~ 50%)[3]
- ácidos gordos de cadeia ímpar[4] (~ 30%)[3]
- ácido propiónico proveniente da fermentação bacteriana[4] (~ 20%)[3]
- cadeia lateral do colesterol[4]
- timina[5]
O derivado do propionato, propionil-CoA, é convertido em D-metilmalonil-CoA pela propionil-CoA carboxilase e depois convertido em L-metilmalonil-CoA pela metilmalonil-CoA epimerase.[6] A entrada no ciclo de Krebs ocorre através da conversão de L-metilmalonil-CoA em succinil-CoA pela L-metilmalonil-CoA mutase, sendo necessária a vitamina B12 sob a forma de adenosilcobalamina como coenzima.[2] Esta via de degradação do propionil-CoA em succinil-CoA representa uma das vias anapleróticas mais importantes do ciclo de Krebs.[7] O ácido metilmalónico é formado como um subproduto desta via metabólica quando o D-metilmalonil-CoA é clivado em ácido metilmalónico e CoA pela D-metilmalonil-CoA hidrolase.[2][5] A enzima acil-CoA sintetase membro da família 3 (acyl-CoA synthetase family member 3, ACSF3) é, por sua vez, responsável pela conversão do ácido metilmalónico e do CoA em metilmalonil-CoA.[8]
As esterases intracelulares são capazes de remover o grupo metilo (-CH3) do ácido metilmalónico e, assim, gerar ácido malónico.[9]
Relevância clínica
editarDeficiência de vitamina B12
editarO aumento dos níveis de ácido metilmalônico pode indicar uma deficiência de vitamina B12, quanto mais elevado, maior a deficiência da vitamina. No entanto, ele é sensível (aqueles com deficiência quase sempre apresentam resultado positivo), mas não específico (aqueles que não têm deficiência de vitamina B12 podem ter níveis elevados de ácido metilmalônico detectados,[10] assim como em casos de insuficiência renal, na gravidez, doenças da tireoide, condições de hemoconcentração e no aumento intestinal de bactérias produtoras de ácido propiônico).[10] O ácido metilmalônico está elevado em 90 a 98% dos pacientes com deficiência de vitamina B12. Sua especificidade é menor, pois 20-25% dos pacientes com mais de 70 anos têm níveis elevados de ácido metilmalónico, mas 25-33% deles não têm deficiência de vitamina B12. Por esse motivo, o teste de ácido metilmalónico não é recomendado rotineiramente em idosos.[11]
Doenças metabólicas
editarUm excesso está associado às acidemias metilmalônicas.
Se os níveis elevados de ácido metilmalônico forem acompanhados por níveis elevados de ácido malônico, isso pode indicar a doença metabólica acidúria malônica e metilmalônica combinada (combined malonic and methylmalonic aciduria, CMAMMA). Ao calcular a relação entre o ácido malônico e o ácido metilmalônico no plasma, a CMAMMA pode ser diferenciada da acidemia metilmalônica clássica.[12]
Cancro
editarAlém disso, o acúmulo de ácido metilmalónico no sangue com a idade foi associado à progressão de tumores em 2020.[13]
Crescimento bacteriano excessivo no intestino delgado
editarO crescimento excessivo de bactérias no intestino delgado também pode levar a níveis elevados de ácido metilmalônico devido à competição das bactérias no processo de absorção da vitamina B12.[14][15] Isso se aplica à vitamina B12 proveniente de alimentos e de suplementação oral e pode ser contornado por injeções de vitamina B12. Também há a hipótese, a partir de estudos de casos de pacientes com síndrome do intestino curto, de que o supercrescimento bacteriano intestinal leva ao aumento da produção de ácido propiónico, que é um precursor do ácido metilmalônico.[16] Foi demonstrado que, nesses casos, os níveis de ácido metilmalônico voltaram ao normal com a administração de metronidazol.[16][17]
Medida
editarAs concentrações de ácido metilmalónico no sangue são medidas por espectrometria de massa com cromatografia gasosa ou LC-MS e os valores esperados de ácido metilmalónico em pessoas saudáveis estão entre 73 e 271 nmol/L.[18][19]
Veja também
editarReferências
- ↑ a b «Dissociation Constants Of Organic Acids And Bases». zirchrom.com
- ↑ a b c Tejero, Joanne; Lazure, Felicia; Gomes, Ana P. (março de 2024). «Methylmalonic acid in aging and disease». Trends in Endocrinology & Metabolism (em inglês) (3): 188–200. PMC 10939937 Verifique
|pmc=(ajuda). PMID 38030482 Verifique|pmid=(ajuda). doi:10.1016/j.tem.2023.11.001 - ↑ a b c d Chandler, R.J.; Venditti, C.P. (setembro de 2005). «Genetic and genomic systems to study methylmalonic acidemia». Molecular Genetics and Metabolism (em inglês) (1-2): 34–43. PMC 2657357 . PMID 16182581. doi:10.1016/j.ymgme.2005.07.020
- ↑ a b c d Baumgartner, Matthias R; Hörster, Friederike; Dionisi-Vici, Carlo; Haliloglu, Goknur; Karall, Daniela; Chapman, Kimberly A; Huemer, Martina; Hochuli, Michel; Assoun, Murielle (dezembro de 2014). «Proposed guidelines for the diagnosis and management of methylmalonic and propionic acidemia». Orphanet Journal of Rare Diseases (em inglês) (1). ISSN 1750-1172. PMC 4180313 . PMID 25205257. doi:10.1186/s13023-014-0130-8
- ↑ a b Kovachy, Robin J.; Stabler, Sally P.; Allen, Robert H. (1988). «[49] d-methylmalonyl-CoA hydrolase». Elsevier (em inglês): 393–400. ISBN 978-0-12-182067-1. doi:10.1016/s0076-6879(88)66051-4
- ↑ Diogo, Rui; Rua, Inês B; Ferreira, Sara; Nogueira, Célia; Pereira, Cristina; Rosmaninho-Salgado, Joana; Diogo, Luísa (31 de outubro de 2023). «Methylmalonyl Coenzyme A (CoA) Epimerase Deficiency, an Ultra-Rare Cause of Isolated Methylmalonic Aciduria With Predominant Neurological Features». Cureus (em inglês). ISSN 2168-8184. doi:10.7759/cureus.48017
- ↑ Collado, M. Sol; Armstrong, Allison J.; Olson, Matthew; Hoang, Stephen A.; Day, Nathan; Summar, Marshall; Chapman, Kimberly A.; Reardon, John; Figler, Robert A. (julho de 2020). «Biochemical and anaplerotic applications of in vitro models of propionic acidemia and methylmalonic acidemia using patient-derived primary hepatocytes». Molecular Genetics and Metabolism (em inglês) (3): 183–196. PMC 7337260 . PMID 32451238. doi:10.1016/j.ymgme.2020.05.003
- ↑ «ACSF3 gene». MedlinePlus (em inglês)
- ↑ McLaughlin, B.A; Nelson, D; Silver, I.A; Erecinska, M; Chesselet, M.-F (maio de 1998). «Methylmalonate toxicity in primary neuronal cultures». Neuroscience (em inglês) (1): 279–290. doi:10.1016/S0306-4522(97)00594-0
- ↑ a b «Sensitivity and Specificity». www.med.emory.edu
- ↑ «B12 Deficiency and Dizziness». www.dizziness-and-balance.com
- ↑ de Sain-van der Velden, Monique G. M.; van der Ham, Maria; Jans, Judith J.; Visser, Gepke; Prinsen, Hubertus C. M. T.; Verhoeven-Duif, Nanda M.; van Gassen, Koen L. I.; van Hasselt, Peter M. (2016), Morava, Eva; Baumgartner, Matthias; Patterson, Marc; Rahman, Shamima, eds., «A New Approach for Fast Metabolic Diagnostics in CMAMMA», ISBN 978-3-662-53680-3, Berlin, Heidelberg: Springer Berlin Heidelberg, JIMD Reports, Volume 30, 30, pp. 15–22, PMC 5110436 , PMID 26915364, doi:10.1007/8904_2016_531
- ↑ Gomes, Ana P.; Ilter, Didem; Low, Vivien; Endress, Jennifer E.; Fernández-García, Juan; Rosenzweig, Adam; Schild, Tanya; Broekaert, Dorien; Ahmed, Adnan; Planque, Melanie; Elia, Ilaria (10 de setembro de 2020). «Age-induced accumulation of methylmalonic acid promotes tumour progression». Nature (em inglês). 585 (7824): 283–287. ISSN 0028-0836. PMC 7785256 . PMID 32814897. doi:10.1038/s41586-020-2630-0
- ↑ Dukowicz, Andrew C.; Lacy, Brian E.; Levine, Gary M. (fevereiro de 2007). «Small Intestinal Bacterial Overgrowth». Gastroenterology & Hepatology (2): 112–122. ISSN 1554-7914. PMC 3099351 . PMID 21960820
- ↑ Giannella, R.A.; Broitman, S.A.; Zamcheck, N. (1972). «Competition Between Bacteria and Intrinsic Factor for Vitamin B12: Implications for Vitamin B12 Malabsorption in Intestinal Bacterial Overgrowth». Gastroenterology. 62 (2): 255–260. ISSN 0016-5085. PMID 4629318. doi:10.1016/s0016-5085(72)80177-x
- ↑ a b Sentongo, Timothy A; Azzam, Ruba; Charrow, Joel (2009). «Vitamin B12 Status, Methylmalonic Acidemia, and Bacterial Overgrowth in Short Bowel Syndrome». Journal of Pediatric Gastroenterology & Nutrition (em inglês). 48 (4): 495–497. ISSN 0277-2116. PMID 19322060. doi:10.1097/MPG.0b013e31817f9e5b
- ↑ Jimenez, Lissette; Stamm, Danielle A.; Depaula, Brittany; Duggan, Christopher P. (2018). «Is Serum Methylmalonic Acid a Reliable Biomarker of Vitamin B12 Status in Children with Short Bowel Syndrome: A Case Series». The Journal of Pediatrics (em inglês). 192: 259–261. PMC 6029886 . PMID 29129351. doi:10.1016/j.jpeds.2017.09.024
- ↑ Isber, Sonia (2007). «The role of poor nutritional status and hyperhomocysteinemia in complicated pregnancy in Syria» (PDF). doi:10.22028/D291-20838
- ↑ «Methylmalonic Acid, Serum or Plasma (Vitamin B12 Status)». ltd.aruplab.com