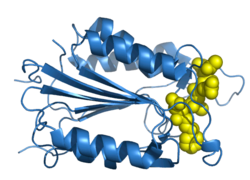
Caspase 3
A caspase 3 é um das caspases existentes. Interage com a caspase 8.
O gene correspondente codifica uma proteína que é membro da família das proteases de cisteína-aspartato. A activação sequêncial das caspases desempenha um papel central na fase de execução da apoptose celular. As caspases existem como pró-enzimas inactivas que depois sofrem um processamento proteolítico em resíduos de aspartato, para produzirem duas subunidades, uma pequena e outra grande, que dimerizam para formar a enzima activa. Esta enzima faz a clivagem e a activação da caspase 6, caspase 7 e caspase 9. A própria proteína é processada pela caspase 8, caspase 9 e caspase 10. É a caspase predominante envolvida na clivagem da proteína percursora amilóide-beta 4A, que está associada à morte neuronal na doença de Alzheimer. O splicing alternativo deste gene resulta em dois transcritos que codificam a mesma proteína.[1]
A Caspase 3 mostrou interação com:
Referências
- ↑ «Entrez Gene: CASP3 caspase 3, apoptosis-related cysteine peptidase»
- ↑ Guo, Yin; Srinivasula Srinivasa M, Druilhe Anne, Fernandes-Alnemri Teresa, Alnemri Emad S (2002). «Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria». United States. J. Biol. Chem. 277 (16): 13430–7. ISSN 0021-9258. PMID 11832478. doi:10.1074/jbc.M108029200
- ↑ Srinivasula, S M; Ahmad M, Fernandes-Alnemri T, Litwack G, Alnemri E S (1996). «Molecular ordering of the Fas-apoptotic pathway: the Fas/APO-1 protease Mch5 is a CrmA-inhibitable protease that activates multiple Ced-3/ICE-like cysteine proteases». UNITED STATES. Proc. Natl. Acad. Sci. U.S.A. 93 (25): 14486–91. ISSN 0027-8424. PMC 26159 . PMID 8962078. doi:10.1073/pnas.93.25.14486
- ↑ Shu, H B; Halpin D R, Goeddel D V (1997). «Casper is a FADD- and caspase-related inducer of apoptosis». UNITED STATES. Immunity. 6 (6): 751–63. ISSN 1074-7613. PMID 9208847. doi:10.1016/S1074-7613(00)80450-1
- ↑ Han, D K; Chaudhary P M, Wright M E, Friedman C, Trask B J, Riedel R T, Baskin D G, Schwartz S M, Hood L (1997). «MRIT, a novel death-effector domain-containing protein, interacts with caspases and BclXL and initiates cell death». UNITED STATES. Proc. Natl. Acad. Sci. U.S.A. 94 (21): 11333–8. ISSN 0027-8424. PMC 23459 . PMID 9326610. doi:10.1073/pnas.94.21.11333
- ↑ Forcet, C; Ye X, Granger L, Corset V, Shin H, Bredesen D E, Mehlen P (2001). «The dependence receptor DCC (deleted in colorectal cancer) defines an alternative mechanism for caspase activation». United States. Proc. Natl. Acad. Sci. U.S.A. 98 (6): 3416–21. ISSN 0027-8424. PMC 30668 . PMID 11248093. doi:10.1073/pnas.051378298
- ↑ Samali, A; Cai J, Zhivotovsky B, Jones D P, Orrenius S (1999). «Presence of a pre-apoptotic complex of pro-caspase-3, Hsp60 and Hsp10 in the mitochondrial fraction of jurkat cells». ENGLAND. EMBO J. 18 (8): 2040–8. ISSN 0261-4189. PMC 1171288 . PMID 10205158. doi:10.1093/emboj/18.8.2040
- ↑ Xanthoudakis, S; Roy S, Rasper D, Hennessey T, Aubin Y, Cassady R, Tawa P, Ruel R, Rosen A, Nicholson D W (1999). «Hsp60 accelerates the maturation of pro-caspase-3 by upstream activator proteases during apoptosis». ENGLAND. EMBO J. 18 (8): 2049–56. ISSN 0261-4189. PMC 1171289 . PMID 10205159. doi:10.1093/emboj/18.8.2049
- ↑ Ruzzene, Maria; Penzo Daniele, Pinna Lorenzo A (2002). «Protein kinase CK2 inhibitor 4,5,6,7-tetrabromobenzotriazole (TBB) induces apoptosis and caspase-dependent degradation of haematopoietic lineage cell-specific protein 1 (HS1) in Jurkat cells». England. Biochem. J. 364 (Pt 1): 41–7. ISSN 0264-6021. PMC 1222543 . PMID 11988074
- ↑ Chen, Y R; Kori R, John B, Tan T H (2001). «Caspase-mediated cleavage of actin-binding and SH3-domain-containing proteins cortactin, HS1, and HIP-55 during apoptosis». United States. Biochem. Biophys. Res. Commun. 288 (4): 981–9. ISSN 0006-291X. PMID 11689006. doi:10.1006/bbrc.2001.5862
- ↑ Tamm, I; Wang Y, Sausville E, Scudiero D A, Vigna N, Oltersdorf T, Reed J C (1998). «IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs». UNITED STATES. Cancer Res. 58 (23): 5315–20. ISSN 0008-5472. PMID 9850056
- ↑ Shin, S; Sung B J, Cho Y S, Kim H J, Ha N C, Hwang J I, Chung C W, Jung Y K, Oh B H (2001). «An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7». United States. Biochemistry. 40 (4): 1117–23. ISSN 0006-2960. PMID 11170436. doi:10.1021/bi001603q
- ↑ Lee, Z H; Lee S E, Kwack K, Yeo W, Lee T H, Bae S S, Suh P G, Kim H H (2001). «Caspase-mediated cleavage of TRAF3 in FasL-stimulated Jurkat-T cells». United States. J. Leukoc. Biol. 69 (3): 490–6. ISSN 0741-5400. PMID 11261798
- ↑ Leo, E; Deveraux Q L, Buchholtz C, Welsh K, Matsuzawa S, Stennicke H R, Salvesen G S, Reed J C (2001). «TRAF1 is a substrate of caspases activated during tumor necrosis factor receptor-alpha-induced apoptosis». United States. J. Biol. Chem. 276 (11): 8087–93. ISSN 0021-9258. PMID 11098060. doi:10.1074/jbc.M009450200
- ↑ Suzuki, Y; Nakabayashi Y, Takahashi R (2001). «Ubiquitin-protein ligase activity of X-linked inhibitor of apoptosis protein promotes proteasomal degradation of caspase-3 and enhances its anti-apoptotic effect in Fas-induced cell death». United States. Proc. Natl. Acad. Sci. U.S.A. 98 (15): 8662–7. ISSN 0027-8424. PMC 37492 . PMID 11447297. doi:10.1073/pnas.161506698
- ↑ Silke, John; Hawkins Christine J, Ekert Paul G, Chew Joanne, Day Catherine L, Pakusch Miha, Verhagen Anne M, Vaux David L (2002). «The anti-apoptotic activity of XIAP is retained upon mutation of both the caspase 3- and caspase 9-interacting sites». United States. J. Cell Biol. 157 (1): 115–24. ISSN 0021-9525. PMC 2173256 . PMID 11927604. doi:10.1083/jcb.200108085
- ↑ Riedl, S J; Renatus M, Schwarzenbacher R, Zhou Q, Sun C, Fesik S W, Liddington R C, Salvesen G S (2001). «Structural basis for the inhibition of caspase-3 by XIAP». United States. Cell. 104 (5): 791–800. ISSN 0092-8674. PMID 11257232. doi:10.1016/S0092-8674(01)00274-4
- ↑ Roy, N; Deveraux Q L, Takahashi R, Salvesen G S, Reed J C (1997). «The c-IAP-1 and c-IAP-2 proteins are direct inhibitors of specific caspases». ENGLAND. EMBO J. 16 (23): 6914–25. ISSN 0261-4189. PMC 1170295 . PMID 9384571. doi:10.1093/emboj/16.23.6914
- ↑ Deveraux, Q L; Takahashi R, Salvesen G S, Reed J C (1997). «X-linked IAP is a direct inhibitor of cell-death proteases». ENGLAND. Nature. 388 (6639): 300–4. ISSN 0028-0836. PMID 9230442. doi:10.1038/40901
- ↑ Suzuki, Y; Nakabayashi Y, Nakata K, Reed J C, Takahashi R (2001). «X-linked inhibitor of apoptosis protein (XIAP) inhibits caspase-3 and -7 in distinct modes». United States. J. Biol. Chem. 276 (29): 27058–63. ISSN 0021-9258. PMID 11359776. doi:10.1074/jbc.M102415200
Leitura de apoio
editar- Cohen GM (1997). «Caspases: the executioners of apoptosis.». Biochem. J. 326 (Pt 1): 1–16. PMC 1218630 . PMID 9337844
- Roig J, Traugh JA (2001). «Cytostatic p21 G protein-activated protein kinase gamma-PAK.». Vitam. Horm. 62: 167–98. PMID 11345898. doi:10.1016/S0083-6729(01)62004-1
- Zhao LJ, Zhu H (2005). «Structure and function of HIV-1 auxiliary regulatory protein Vpr: novel clues to drug design.». Curr. Drug Targets Immune Endocr. Metabol. Disord. 4 (4): 265–75. PMID 15578977. doi:10.2174/1568008043339668
- Le Rouzic E, Benichou S (2006). «The Vpr protein from HIV-1: distinct roles along the viral life cycle.». Retrovirology. 2. 11 páginas. PMC 554975 . PMID 15725353. doi:10.1186/1742-4690-2-11
- Sykes MC, Mowbray AL, Jo H (2007). «Reversible glutathiolation of caspase-3 by glutaredoxin as a novel redox signaling mechanism in tumor necrosis factor-alpha-induced cell death.». Circ. Res. 100 (2): 152–4. PMID 17272816. doi:10.1161/01.RES.0000258171.08020.72