Ferroceno
| Ferroceno Alerta sobre risco à saúde | |
|---|---|

|
|

| |
| Nome IUPAC | *bis(η5-ciclopentadienil)ferro
|
| Outros nomes | diciclopentadienil-ferro |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| ChEBI | |
| SMILES |
|
| InChI | 1/2C5H5.Fe/c2*1-2-4-5-3-1;/h2*1-5H;/q2*-1;+2
|
| Propriedades | |
| Fórmula molecular | C10H10Fe |
| Massa molar | 186.04 g/mol |
| Aparência | Pó alaranjado-claro |
| Densidade | 1.107 g/cm3 (0°C), 1.490 g/cm3 (20 °C)[1] |
| Ponto de fusão |
174 °C |
| Ponto de ebulição |
249 °C |
| Solubilidade em água | Insolúvel em água, solúvel nos demais solventes orgânicos |
| Compostos relacionados | |
| Compostos relacionados | Cobaltoceno Niqueloceno Cromoceno Di(benzeno)cromo Dicloreto de titanoceno Ferrocênio (catião) dicarbolídeo |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
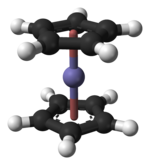
Ferroceno é um composto organometálico de fórmula Fe(C5H5)2. É o protótipo do metaloceno, uma classe de compostos organometálicos, e consiste de dois anéis ciclopentadienil presos a lados opostos de um átomo central de metal. Tais compostos são também conhecidos com compostos sanduíche.[2] O crescimento rápido da química organometálica é muitas vezes atribuído ao excitamento vindo da descoberta do ferroceno e seus outros muitos análogos.
História
editarO ferroceno foi descoberto incidentalmente.
Em 1951, Pauson e Kealy na Duquesne University, reportaram a reação de brometo de ciclopentadienil-magnésio com cloreto férrico , com o objetivo de oxidativamente acoplar o dieno para preparar fulvaleno.
Em vez disso, obtiveram um pó alaranjado-claro de "notável estabilidade."[3][4] Esta estabilidade estava de acordo com o caráter aromático dos ciclopentadienis negativamente carregados, mas a estrutura sanduíche do η5 (pentahapto) composto não foi reconhecida por eles.
Robert Burns Woodward e Geoffrey Wilkinson deduziram a estrutura baseados na reatividade da substância.[5]
Independentemente o alemão Ernst Otto Fischer também chegou à conclusão da estrutura sanduíche e começou a sintetizar outros metalocenos, tais como niqueloceno e cobaltoceno.[6][7] A estrutura do ferroceno foi confirmada por espectroscopia NMR e cristalografia de raios X.[8][9] Sua estrutura diferenciada "sanduíche" levou a uma explosão de interesse em compostos de metais do bloco d com hidrocarbonetos, e revigorou o dessenvolvimento da florescente química organometálica. Em 1973 Fischer do Technische Universität München e Wilkinson do Imperial College London dividiram um Prêmio Nobel por seu trabalho sobre metalocenos e outros aspectos da química organometálica.[10]
Estrutura e ligação
editarO átomo de ferro no ferroceno é normalmente apresentado como tendo NOx +2, como pode ser mostrado pela espectroscopia Mössbauer. Em cada anel ciclopentadienil (Cp) é alocada uma única carga negativa, levando a seis o número de elétrons π em cada anel, e assim os tornando aromáticos. Estes doze elétrons (seis de cada anel) são então compartilhados com o metal por meio de ligação covalente háptica (um tipo de ligação três centros dois elétrons deslocalizada), que, quando combinada aos seis d-elétrons no Fe2+, resulta no complexo tendo configuração de 18 elétrons.
A falta de ligações individuais fixas entre os átomos de carbono do anel ciclopentadienil (Cp) e o íon Fe2+ (devido à natureza fluxional dessas ligações) resulta em os anéis Cp girarem livremente ao redor do eixo Cp(centróide)-Fe-Cp(centróide), como observado por ressonância magnética nuclear[11] e microscopia eletrônica de tunelamento.[12][13]
A distância entre as ligações carbono-carbono é de 1.40 Å entre os cinco membros de cada anel, e entre as ligações Fe-C é de 2.04 Å.
Síntese e propriedades de manipulação
editarA primeira síntese relatada[14] de ferroceno utilizou reagente de Grignard brometo de ciclopentadienil-magnésio, o qual pode ser preparado reagindo ciclopentadieno com magnésio e bromoetano em benzeno anidro. Cloreto de ferro(II) é então suspenso em éter dietílico anidro e adicionado ao reagente de Grignard. A sequência da reação é:
- 2 C5H5MgBr + FeCl2 → Fe(C5H5)2 + MgCl2 + MgBr2
Inúmeras outras sínteses foram reportadas, incluindo a reação de ciclopentadieno em fase gasosa com ferro metálico[15] a 350 °C ou com pentacarbonil de ferro.[16]
- Fe + 2 C5H6(g) → Fe(C5H5)2 + H2(g)
- Fe(CO)5 + 2 C5H6(g) → Fe(C5H5)2 + 5 CO(g) + H2(g)
Métodos de preparação mais eficientes são geralmente modificações da sequência original de transmetalação usando o ciclopentadieneto de sódio[17] ou ciclopentadieno crackeado e hidróxido de potássio[18] com cloreto de ferro(II) anidro en solventes etéreos:
- 2 NaC5H5 + FeCl2 → Fe(C5H5)2 + 2 NaCl
- FeCl2.4H2O + 2 C5H6 + 2 KOH → Fe(C5H5)2 + 2 KCl + 6 H2O
Transmetalação direta pode ainda ser usada para preparar ferroceno a partir de outros metalocenos, como o manganoceno:[19]
- FeCl2 + Mn(C5H5)2 → MnCl2 + Fe(C5H5)2
Como esperado para espécies simétricas e eletricamente neutras, o ferroceno é solúvel em solventes orgânicos comuns, como o benzeno, mas é insolúvel em água. Ferroceno é um composto sólido alaranjado estável ao ar que facilmente sublima, especialmente se aquecido no vácuo. É estável a temperaturas de cerca de 400 °C.[20] A tabela seguinte dá os valores típicos de pressão de vapor do ferroceno a diferentes temperaturas:[21]
| pressão(Pa) | 1 | 10 | 100 |
|---|---|---|---|
| temperatura(K) | 298 | 323 | 353 |
Reações
editarCom eletrófilos
editarO ferroceno sofre muitas reações características dos compostos aromáticos, permitindo a preparação de muitos derivados substituídos. Um experimento acadêmico muito comum é a reação de Friedel-Crafts do ferroceno com anidrido acético (ou cloreto de acetila) na presença de ácido fosfórico como catalisador.
Litiação
editarO ferroceno reage facilmente com butil-lítio formando 1,1'-dilitioferroceno, que por sua vez é um nucleófilo versátil. Mas a reação de ferroceno com t-BuLi produz unicamente monolitioferroceno.[22] estes métodos são especialmente úteis para introduzir grupos funcionais principais, por ex. usando S8, clorofosfinas, clorossilanos. Os compostos lineares sofrem polimerização com abertura de anel.[23]
Derivados do fósforo
editarMuitos derivados de fosfina dos ferrocenos são conhecidos e alguns utilizados em processos comercializados.[24] O mais simples e melhor conhecido é o 1,1'-bi(difenilfosfino)ferroceno (dppf) preparado a partir do dilitioferroceno. Por exemplo, na presença de cloreto de alumínio,ferroceno e Me2NPCl2 reagem para formar ferrocenil-diclorofosfina,[25] já que o tratamento com diclorofenilfosfina sob condições similares forma P,P-diferrocenil-P-fenil-fosfina.[26] Semelhantemente ao anisol a reação do ferroceno com P4S10 forma dissulfeto de ditiodifosfetano.[27]
Química redox
editarDiferente da maioria dos compostos orgânicos, o ferroceno sofre uma oxidação de um elétron a baixo potencial, a cerca de 0.5 V vs. um Eletrodo Saturado de Calomelano (SCE). é também usado como padrão em eletroquímica: Fc+/Fc = 0.64 V vs. SHE. Alguns compostos orgânicos ricos em elétrons (por ex., anilina) são oxidados a baixos potenciais, mas só irreversivelmente. A oxidação do ferroceno dá origem a um cátion estável chamado ferrocênio. Em grande escala, a oxidação é convenientemente efetuada por FeCl3, originando o íon azulado, [Fe(C5H5)2]+, o qual é quase sempre isolado na forma de PF6−. Alternativamente, nitrato de prata pode ser usado como oxidante.
Sais de ferrocênio são utilizados às vezes como agentes oxidantes, em parte por o produto (ferroceno) é inerte facilmente separado dos produtos iônicos.[28] Substituintes nos ligantes ciclopentadienil alteram o potencial de redox na maneira esperada: grupos que repelem elétrons, como o grupo carboxila, alteram o potencial na direção anódica (i.e. tornam mais positivo), e grupos que liberam elétrons. como metil, alteram o potencial na direção do cátodo (mais negativo). Dessa forma, decametilferroceno é muito mais facilmente oxidado que ferroceno. O ferroceno é geralmente usado como um padrão interno para calibrar potenciais redox em eletroquímica não aquosa.
Estereoquímica
editarVários padrões de substituição são possíveis com o ferroceno, incluindo a substituição em um ou ambos anéis. Os padrões mais comuns são 1-substituídos (um substituinte em um anel) e 1,1'-dissubstituídos (um substituinte em cada anel). Normalmente os anéis têm total liberdade de rotação, o que simplifica o isomerismo. Ferrocenos dissubstituídos podem existir como isômeros 1,2, 1.3 ou 1,1', nenhum dos quais é interconvertível. Ferrocenos assimetricamente dissubstituídos em um anel são quirais - por exemplo O [CpFe(EtC5H3Me)] é quiral mas o [CpFe(C5H3Me2)] is aquiral. Essa quiralidade planar aumenta apesar de nenhum átomo ser um centro estereogênico. O ferroceno substituído mostrado à direita (um derivado da 4-(dimetilamino)piridina) se mostrou efetivo quando usado para resolução cinética de álcoóis secundários racêmicos.[29]
Aplicações do ferroceno e seus derivados
editarO ferroceno e seus numerosos derivados não são aplicados em larga escala, mas apresentam muitos usos estritos que exploram a estrutura incomum (suporte de ligantes, candidatos a medicamento), solidez (formulações antidetonantes, precursores de materiais), e redox (reagentes e padrões de redox).
Aditivos de combustível
editarFerroceno e seus derivados são agentes antidetonantes usados em combustíveis de motores de explosão; são mais seguros do que o tetraetilchumbo, anteriormente usado.[30] É possível comprar na Halfords, no Reino Unido, uma solução de aditivo de petróleo que contém ferroceno e que pode ser adicionada à gasolina comum (sem chumbo) de carros vintage, desenhados para usar gasolina com chumbo.[31] Os depósitos de ferro gerados pela decomposição do ferroceno podem formar uma camada condutiva na superfície das velas.
Química de materiais
editarO ferroceno, por ser facilmente decomposto em nanopartículas de ferro, é utilizado como catalisador na produção de nanotubos de carbono.[32] Muitas reações orgânicas podem ser usadas para modificar ferrocenos, o que é o caso do vinil-ferroceno. O vinil-ferroceno é formado por uma reação de Wittig de um aldeído, um sal de fosfônio e hidróxido de sódio.[33] O vinil-ferroceno pode ser convertido em um polímero que se acredita ser a versão ferrocenil do poliestireno (os grupos fenil estão trocados por grupos ferrocenil).
Como suporte de ligantes
editarFerrocenil-fosfinas quirais são empregadas como ligantes para reações catalisadas por metais de transição. Algumas delas encontraram aplicações industriais na síntese de medicamentos e agroquímicos. Por exemplo, a difosfina 1,1'-bi(difenilfosfino)ferroceno (dppf) é um ligante valioso para reações de acoplamento catalisadas por paládio.
Referências
- ↑ «Ferrocene(102-54-5)». Consultado em 3 de fevereiro de 2010
- ↑ Federman Neto, Alberto; Pelegrino, Alessandra Caramori; Darin, Vitor Andre (2004). «Ferrocene: 50 Years of Transition Metal Organometallic Chemistry — From Organic and Inorganic to Supramolecular Chemistry». ChemInform. 35. doi:10.1002/chin.200443242
- ↑ a b T. J. Kealy, P. L. Pauson (1951). «A New Type of Organo-Iron Compound». Nature. 168. 1039 páginas. doi:10.1038/1681039b0
- ↑ Um segundo grupo descobriu ferroceno de forma independente. See: S. A. Miller, J. A. Tebboth, and J. F. Tremaine (1952) "Dicyclopentadienyliron," Journal of the Chemical Society (London) , pages 632-635. Veja também: Pierre Laszlo and Roald Hoffmann (2000) "Ferrocene: Ironclad History of Rashomon Tale?," Angewandte Chemie (International Edition), vol. 39, no. 1, pages 123-124.
- ↑ G. Wilkinson, M. Rosenblum, M. C. Whiting, R. B. Woodward (1952). «The Structure of Iron Bis-Cyclopentadienyl». Journal of the American Chemical Society. 74: 2125–2126. doi:10.1021/ja01128a527
- ↑ E. O. Fischer, W. Pfab (1952). «Zur Kristallstruktur der Di-Cyclopentadienyl-Verbindungen des zweiwertigen Eisens, Kobalts und Nickels». Zeitschrift für Naturforschung B. 7: 377–379
- ↑ Um terceiro grupo determinou independentemente a estrutura do ferroceno. Veja: P. F. Eiland and R. Pepinsky (1952) "X-ray examination of iron biscyclopentadienyl," Journal of the American Chemical Society, vol. 74, page 4971. See also: Pierre Laszlo and Roald Hoffmann (2000) "Ferrocene: Ironclad History of Rashomon Tale?," Angewandte Chemie (International Edition), vol. 39, no. 1, pages 123-124.
- ↑ J. Dunitz, L. Orgel, A. Rich (1956). «The crystal structure of ferrocene». Acta Crystallographica. 9: 373–375. doi:10.1107/S0365110X56001091
- ↑ Pierre Laszlo, Roald Hoffmann, (2000). «Ferrocene: Ironclad History or Rashomon Tale?». Angewandte Chemie International Edition. 39: 123–124. doi:10.1002/(SICI)1521-3773(20000103)39:1<123:AID-ANIE123>3.0.CO;2-Z
- ↑ «Press Release: The Nobel Prize in Chemistry 1973». The Royal Swedish Academy of Sciences. 1973
- ↑ E. W. Abel, N. J. Long, K. G. Orrell, A. G. Osborne, V. Sik (1991). «Dynamic NMR studies of ring rotation in substituted ferrocenes and ruthenocenes». Journal of Organometallic Chemistry. 403: 195–208. doi:10.1016/0022-328X(91)83100-I
- ↑ L. F. N. Ah Qune, K. Tamada, M. Hara (2008). «Self-Assembling Properties of 11-Ferrocenyl-1-Undecanethiol on Highly Oriented Pyrolitic Graphite Characterized by Scanning Tunneling Microscopy». E-Journal of Surface Science and Nanotechnology. 6: 119–123. doi:10.1380/ejssnt.2008.119
- ↑ Self-Assembling Properties of 11-Ferrocenyl-1-Undecanethiol on Highly Oriented Pyrolitic Graphite Characterized by Scanning Tunneling Microscopy[ligação inativa]
- ↑ Kealy, T. J.; Pauson, P. L. (1951). Nature. 168. 1039 páginas
- ↑ Wilkinson, G.; Pauson, P. L.; Cotton, F. A. (1954). J. Am. Chem. Soc. 76. 1970 páginas. doi:10.1021/ja01636a080
- ↑ Wilkinson, G.; Cotton, F. A. (1959). «Cyclopentadienyl and Arene Metal Compounds». Progress in Inorganic Chemistry. 1: 1–124. doi:10.1002/9780470166024.ch1
- ↑ Geoffrey Wilkinson (1963). «Ferrocene». Org. Synth.; Coll. Vol., 4
- ↑ Jolly, W. L., The Synthesis and Characterization of Inorganic Compounds, Prentice-Hall: New Jersey, 1970.
- ↑ Wilkinson, G.; Cotton, F. A.; Birmingham, J. M. (1956). «On manganese cyclopentadienide and some chemical reactions of neutral bis-cyclopentadienyl metal compounds». J. Inorg. Nucl. Chem. 2. 95 páginas. doi:10.1016/0022-1902(56)80004-3
- ↑ Solomons, Graham, and Craig Fryhle. Organic Chemistry. 9th ed. USA: John Wiley & Sons, Inc., 2006.
- ↑ Monte, Manuel J. S.; Santos, Luís M. N. B. F.; Fulem, Michal; Fonseca, José M. S.; Sousa, Carlos A. D. (2006). «New Static Apparatus and Vapor Pressure of Reference Materials: Naphthalene, Benzoic Acid, Benzophenone, and Ferrocene». Journal of Chemical & Engineering Data. 51. 757 páginas. doi:10.1021/je050502y
- ↑ F Rebierea, O Samuela and H.B Kagan "A convenient method for the preparation of monolithioferrocene" Tetrahedron Letters Volume 31, Issue 22, 1990, Pages 3121-3124. doi:10.1016/S0040-4039(00)94710-5
- ↑ David E. Herbert, Ulrich F. J. Mayer, Ian Manners “Strained Metallocenophanes and Related Organometallic Rings Containing pi-Hydrocarbon Ligands and Transition-Metal Centers” Angew. Chem. Int. Ed. 2007, volume 46, 5060 - 5081. doi:10.1002/anie.200604409
- ↑ Petr Stepnicka "Ferrocenes: Ligands, Materials and Biomolecules" J. Wiley, Hoboken, 2008. ISBN 0470035854
- ↑ G.R. Knox, P.L. Pauson and D. Willison (1992). «Ferrocene derivatives. 27. Ferrocenyldimethylphosphine». Organometallics. 11 (8): 2930–2933. doi:10.1021/om00044a038
- ↑ G.P. Sollott, H.E. Mertwoy, S. Portnoy and J.L. Snead (1963). «Unsymmetrical Tertiary Phosphines of Ferrocene by Friedel-Crafts Reactions. I. Ferrocenylphenylphosphines». J. Org. Chem. 28: 1090–1092. doi:10.1021/jo01039a055
- ↑ Mark R. St. J. Foreman, Alexandra M. Z. Slawin and J. Derek Woollins (1996). «2,4-Diferrocenyl-1,3-dithiadiphosphetane 2,4-disulfide; structure and reactions with catechols and [PtCl2(PR3)2](R = Et or Bun)». J. Chem. Soc., Dalton Trans.,: 3653–3657. doi:10.1039/DT9960003653
- ↑ N. G. Connelly, W. E. Geiger (1996). «Chemical Redox Agents for Organometallic Chemistry». Chemical Reviews. 96: 877–910. PMID 11848774. doi:10.1021/cr940053x
- ↑ Ruble, J. C.; Latham, H. A.; Fu, G. C. (1997). «Effective Kinetic Resolution of Secondary Alcohols with a Planar-Chiral Analogue of 4-(dimethylamino)pyridine. Use of the Fe(C5Ph5) Group in Asymmetric Catalysis». J. Am. Chem. Soc. 119 (6): 1492–1493. doi:10.1021/ja963835b
- ↑ «Application of fuel additives» (PDF). Consultado em 5 de maio de 2011. Arquivado do original (PDF) em 5 de maio de 2006
- ↑ Patente E.U.A. 4 104 036
- ↑ Devin Conroya, Anna Moisalab, Silvana Cardosoa, Alan Windleb and John Davidson,Chemical Engineering Science,2010,65,2965-2977
- ↑ Liu, Wan-yi; Xu, Qi-hai; Ma, Yong-xiang; Liang, Yong-min; Dong, Ning-li; Guan, De-peng,J. Organomet. Chem., 2001, 625, 128 - 132
Leitura posterior
editar- Miller, S. A., Tebboth, J. A., Tremaine, J. F. (1952). «114. Dicyclopentadienyliron». J. Chem. Soc.: 632–635. doi:10.1039/JR9520000632
- Anúncio da estrutura correta em 'sanduíche'
- Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. (1952). «The Structure of Iron Bis-Cyclopentadienyl». J. Am. Chem. Soc. 74: 2125–2126. doi:10.1021/ja01128a527
- Fischer, E. O., Pfab, W. (1952). «Cyclopentadien-Metallkomplexe, ein neuer typ metallorganischer Verbindungen». Z. Naturforsch. B. 7: 377–379
- Outros
- Dunitz, J. D., Orgel, L. E. (1953). «Bis-Cyclopentadienyl - A Molecular Sandwich». Nature. 171: 121–122. doi:10.1038/171121a0
- Pauson, P. L. (2001). «Ferrocene-how it all began». J. Organomet. Chem. 637-639: 637–639. doi:10.1016/S0022-328X(01)01126-3
- Gerard Jaouen (ed.) (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. ISBN 978-3-527-30990-0 (discussão do papel biológico do ferroceno e compostos relacionados)
- University of Nottingham Molecular Videos, "Ferrocene"
- Ferroceno Guidechem.com