Isótopo
Isótopos são dois ou mais tipos de átomos que têm o mesmo número atômico (número de prótons em seus núcleos) e posição na tabela periódica (e, portanto, pertencem ao mesmo elemento químico), e que diferem em número de particulas nucleares (números de massa) devido a diferentes números de nêutrons em seus núcleos.[1] Embora todos os isótopos de um determinado elemento tenham quase as mesmas propriedades químicas, eles têm massas atômicas e propriedades físicas diferentes.[2]
Os isótopos têm propriedades exclusivas e essas propriedades os tornam úteis em aplicações de diagnóstico e tratamento. Eles são importantes em medicina nuclear, exploração de petróleo e gás, pesquisa básica e segurança nacional.[3]
Etimologia
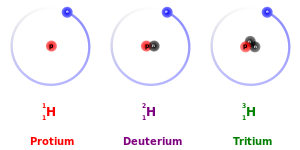
editarO termo isótopo é formado a partir das raízes gregas isos (ἴσος "igual") e Topos ("lugar" τόπος). Assim: "o mesmo lugar", significando que diferentes isótopos de um único elemento ocupam a mesma posição na tabela periódica. O número de prótons dentro do núcleo do átomo identifica unicamente um elemento, mas um determinado elemento pode, em princípio, ter qualquer número de nêutrons. O número de núcleons (soma de prótons e nêutrons) no núcleo é o número de massa, e cada isótopo de um determinado elemento tem um número de massa diferente. A diferença nos pesos atómicos resulta de diferenças no número de nêutrons nos núcleos atómicos, ou seja, os isótopos são átomos que possuem a mesma quantidade de prótons, mas não a mesma de nêutrons. Ex.: O átomo de hidrogênio possui três formas de isótopos: o prótio (1 próton sem nêutron) o deutério (1 próton e 1 nêutron) e o trítio (1 próton e 2 nêutrons).[4] O carbono-12, carbono-13 e carbono-14 são três isótopos do elemento carbono com os números de massa 12, 13 e 14, respectivamente. O número atômico do carbono é 6 (= número de prótons no núcleo), o que significa que cada átomo de carbono tem 6 prótons, de modo que os números de nêutrons destes isótopos são 6, 7 e 8, respectivamente.
Sistema de nomeação
editarNa nomenclatura científica, os isótopos são designados pelo nome do elemento seguido por um hífen e pelo número de núcleons (prótons e nêutrons) no núcleo atómico (ex: ferro-57, urânio-238, hélio-3). Na forma simbólica, o número de núcleons é escrito como um prefixo subido do símbolo químico (ex: 57Fe, 238U, ³He).
Existem 339 isótopos naturais na Terra.[5] E mais de 3100 são conhecidos.[6]
Ver também
editarReferências
- ↑ «Isotope - an overview | ScienceDirect Topics». www.sciencedirect.com. Consultado em 29 de junho de 2021
- ↑ «isotope | Examples & Definition». Encyclopædia Britannica (em inglês). Consultado em 29 de junho de 2021
- ↑ Energy, U. S. Department of (18 de junho de 2021). «Science Made Simple: What Are Isotopes?». SciTechDaily (em inglês). Consultado em 29 de junho de 2021
- ↑ I. KAPLAN, Nuclear Physics, Addison-Wesley Publishing Company Inc., Reading, 1977.
- ↑ «Radioactives Missing From The Earth»
- ↑ «NuDat 2 Description»
Ligações externas
editar- Radioatividade: apostila educativa
- Nucleonica Nuclear Science Portal
- Nucleonica Nuclear Science Wiki
- International Atomic Energy Agency
- Atomic weights of all isotopes
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope
- Chart of the Nuclides produced by the Knolls Atomic Power Laboratory $25
- Exploring the Table of the Isotopes at the LBNL
- Current isotope research and information
- Radioactive Isotopes by the CDC
- Interacive Chart of the nuclides, isotopes and Periodic Table Arquivado em 30 de setembro de 2008, no Wayback Machine.