Metabolismo das drogas
Metabolismo das drogas refere-se ao processo metabólico das drogas, sua modificação bioquímica ou degradação, geralmente através de sistemas enzimáticos especializados. É uma forma de metabolismo xenobiótico. O metabolismo das drogas geralmente converte compostos químicos lipofílicos em produtos mais prontamente excretados. Sua taxa é um determinante importante da duração e intensidade da ação farmacológica das drogas.
As características lipofílicas dos fármacos que promovem sua passagem através das membranas biológicas e acesso subsequente a seu local de ação dificultam sua excreção do corpo. A excreção renal de fármacos inalterados desempenha um papel apenas modesto na eliminação geral da maioria dos agentes terapêuticos, já que os compostos lipofílicos filtrados através do glomérulo são amplamente reabsorvidos de volta para a circulação sistêmica durante a passagem através dos túbulos renais.
O metabolismo de fármacos e outros xenobióticos em metabólitos mais hidrofílicos é, portanto, fundamental para a eliminação desses compostos do corpo e o término da sua atividade biológica. Em geral, as reações de biotransformação geram metabólitos mais polares, inativos, que são rapidamente excretados do corpo. No entanto, em alguns casos, são gerados metabólitos com atividade biológica potente ou propriedades tóxicas.
Muitas das reações de biotransformação metabólica levando a metabólitos inativos de fármacos também geram metabólitos biologicamente ativos de compostos endógenos.
Metabolismo de Fase I e II
editarAs reações de biotransformação dos fármacos são classificadas em reações funcionais de fase I ou reações biossintéticas (conjugação) de fase II.
As reações de fase I introduzem ou expõe um grupo funcional no fármaco parental. As reações de fase I geralmente levam à perda da atividade farmacológica, embora haja exemplos de manutenção ou aumento da atividade. Em raros casos, o metabolismo está associado à alteração da atividade farmacológica.
Os pró-fármacos, são compostos farmacologicamente inativos, projetados para maximizar a quantidade da espécie ativa que alcança o local de ação. Os pró-fármacos inativos são rapidamente convertidos em metabólitos biologicamente ativos, frequentemente pela hidrólise de uma ligação éster ou amida. Quando não são rapidamente excretados na urina, os produtos das reações de biotransformação de fase I podem reagir com compostos endógenos, formando um conjugado altamente hidrossolúvel.
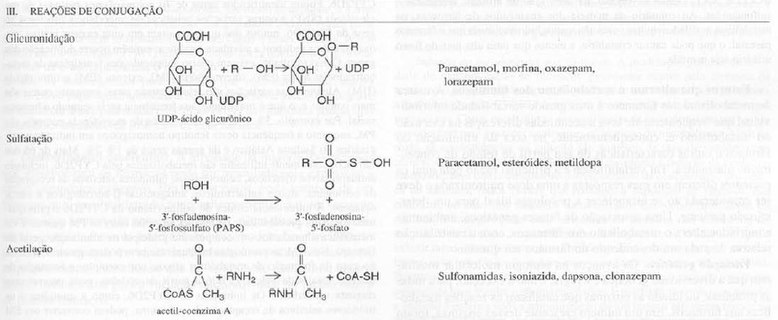
As reações de conjugação de fase II, levam à formação de uma ligação covalente entre um grupo funcional no fármaco parental ou metabólito de fase I com ácido glicurônico, sulfato, glutationa, aminoácidos ou acetatos endógenos. Tais conjugados altamente polares, em geral, são inativos e excretados rapidamente na urina ou nas fezes. Um exemplo de conjugado ativo é o metabólito 6-glicuronído da morfina, um analgésico mais potente que o fármaco do qual se origina.
Local de biotransformação
editarA conversão metabólica dos fármacos geralmente é de natureza enzimática. Os sistemas enzimáticos envolvidos na biotransformação dos fármacos estão localizados no fígado, embora qualquer tecido examinado tenha alguma atividade metabólica. Outros órgãos com capacidade metabólica importante são o trato digestivo, os rins e os pulmões. Após a administração não-parenteral de um fármaco, uma parte significativa da dose pode ser metabolicamente inativado no epitélio intestinal ou no fígado antes de alcançar a circulação sistêmica. Esse metabolismo de primeira passagem limita de modo importante a disponibilidade oral de fármacos altamente metabolizados. No interior de determinado célula, a maior parte do metabolismo de fármacos se encontra no retículo endoplasmático e no citosol, embora também possam ocorrem biotransformações nas mitocôndrias, no invólucro nuclear e na membrana plasmática. Com a homogeneização e a centrifugação diferencial dos tecidos, o retículo endoplasmático se quebra e os fragmentos da membrana formam microvesículas, denominadas microssomos.
As enzimas que metabolizam as substâncias no retículo endoplasmático costumam ser, portanto, classificadas como enzimas microssômicas. Os sistemas enzimáticos envolvidos nas reações de fase I se localizam primariamente no retículo endoplasmático, enquanto os sistemas enzimáticos de conjugação de fase II estão principalmente no citosol. Muitas vezes, os fármacos biotransformados por reações de fase I no retículo endoplasmático são conjugados nesse mesmo local ou no citosol da mesma célula.


Sistema do citocromo P450 monoxigenase. As enzimas do citocromo P450 são uma superfamília de proteínas heme-tiolato amplamente distribuídas através de todos os reinos vivos. As enzimas estão envolvidas no metabolismo de uma variedade de compostos quimicamente diferentes, endógenos e exógenos, incluindo fármacos, substancias ambientais e outros xenobióticos. Geralmente funcionam como um terminal oxidade em uma cadeia de transferência de elétrons com múltiplos componentes que introduz um único átomo de oxigênio molecular ao substrato, com outro átomo sendo incorporado na água. Nos microssomos, os elétrons são fornecidos de NADPH via redutase do citocromo P450, que está estreitamente associada ao citocromo P450 na membrana lipídica do retículo endoplasmático liso. O citocromo P450 catalisa muitas reações, inclusive a hidroxilação aromática e de cadeia lateral; dealquilação N, O e S; N-oxidação; N-hidroxilação; sulfoxidação; desaminação; desalogenação e dessulfuração. Várias reações de redução também são catalisadas por essas enzimas, geralmente em condições de baixa tensão de oxigênio.
Das aproximadamente 1000 enzimas conhecidas atualmente no citocromo P450, cerca de 50 têm atividade funcional nos seres humanos, sendo categorizados em 17 famílias e muitas subfamílias segundo as semelhanças entre as sequencias de aminoácidos das proteínas previstas; a sigla CYP é utilizada para sua identificação. Aa sequências iguais em mais de 40% pertencem à mesma família, identificada por um algarismo arábico; no interior de uma família, as sequências iguais em mais de 55% estão na mesma subfamília, identificada por uma letra; e as diferentes isoformas isoladas na subfamília são identificadas por algarismo arábico. Cerca de 8 a 10 isoformas nas famílias CYP1, CYP2 e CYP3 estão primariamente envolvidas na maior parte das reações metabólicas de todos os fármacos nos seres humanos,; os membros das outras famílias são importantes para a biossíntese e a degradação de esteroides, ácidos graxos, vitaminas e outros compostos endógenos. Cada isoforma isolada de CYP parece ter especificidade característica para um substrato com base nas manifestações estruturais do substrato; no entanto, muitas vezes há uma superposição considerável. Como resultado, duas ou mais isoformas CYP e outras enzimas que metabolizam fármacos frequentemente estão envolvidas no metabilismo geral de um fármaco, levando à formação de muitos metabólitos primários e secundários. As diferenças isoformas também possuem perfis característicos de inibição e indução. Em acréscimo, o metabolismo catalisado pela CYP muitas vezes é regional e estereosseletivo; a última característica pode ser importante se o fármaco administrado for um racemato e os enantiômeros tiverem atividade farmacológica diferente.
A CYP3A4 e a CYP3A5, que são isoformas muito semelhantes, juntas estão envolvidas no metabolismo de cerca de 50% dos fármacos; além disso, a CYP3A é expressa no epitélio intestinal e no rim. Atualmente se reconhece que o metabolismo pela CYP3A durante a absorção pelos enterócitos intestinais é um fator importante, junto com o metabolismo hepático de primeira passagem, na pouca biodisponibilidade oral de muitos fármacos. Isoformas da família CYP2C e da subfamília CYPD6 também estão envolvidas em grande escala no metabolismo dos fármacos. Embora isoformas como CYP1A1/2, CYP2A6, CYP2B1 e CYP2E1 não estejam grandemente envolvidas no metabolismo de medicamentos, elas, no entanto, catalisam a ativação de muitos agentes ambientais pró-cancerígenos até sua forma cancerígena final. Consequentemente, são consideradas importantes na sensibilidade a varias neoplasias, como câncer de pulmão associado ao tabagismo.
Outras enzimas oxidativas como as desidrogenases e as monoxigenases contendo flavina também são capazes de catalisar o metabolismo de determinados fármacos, mas em geral têm pouca importância no conjunto.
Enzimas hidrolíticas. Foram identificadas muitas esterases e amidases inespecíficas no retículo endoplasmático do fígado, do intestino e de outros tecidos humanos. Os grupos álcool e amina expostos após a hidrólise dos ésteres e amidas são substratos adequados para as reações de conjugação. A epóxido-hidrolase microssômica é encontrada no retículo endoplasmático de fundamentalmente todos os tecidos, estando muito perto das enimas do citocromo P450. A epóxido-hidrolase é geralmente considerada uma enzima de detoxificação, hidrolisando óxidos arene (óxidos derivados de compostos aromáticos, ou seja, com estruturas semelhantes a do anel benzêmico) altamente reativos gerados através das reações de oxidação do citocromo P450 em metabólitos transdiidrodiol inativos hidrossolúveis. As enzimas protease e peptidase são amplamente distribuídas em muitos tecidos, e estão envolvidas na biotransformação de fármacos polipeptídios. A passagem desses fármacos através das membranas biológicas exige a inibição dessas enzimas ou o desenvolvimento de análogos estáveis.
Reações de conjugação. Tanto a forma ativiada de um composto endógeno como uma enzima transferase apropriada são necessárias para a formação de um metabólito conjugado. No caso da glicuronidação – a mais importante reação de conjugação – a difosfato de uridina glicuronosiltransferases (UGT) catalisam a transferência de ácido glicurônico para álcoois aromáticos e alifáticos, ácidos carboxílicos, aminas e grupos sulfidrila livres de compostos tanto exógenos como endógenos para formar glicuronídeos O, N e S, respectivamente. A glicuronidação também é importante na eliminação de esteroides endógenos, bilirrubina, ácidos biliares e vitaminas lipossolúveis. A maior solubilidade na agua de um glicuronídeo conjugado promove sua eliminação na urina ou na bile. Diferente da maior parte das reações de fase II, que ocorrem no citosol, as UGT são enzimas microssômicas, localização que facilita o acesso direto de metabólitos de fase I formados no mesmo local. Além de no fígado, as UGT também são encontradas no epitélio intestinal, nos rins e na pele. Foram identificadas cerca de 15 UGT humanas e, com base na semelhança entre os aminoácido, foram classificas duas famílias principais. Os membros da família UGT1A humana são todos codificados por um complexo de genes e as isoformas isoladas são produzidas pela junção alternativa de 12 promotores/éxon 1 com éxons 2-5 comuns para a produção de várias proteínas diferentes. Ao contrário, a UGT2 contém apenas três subfamílias: 2ª, 2B e 2C. Embora pareça que cada UGT tenha especificidades características para determinado substrato, há considerável superposição, de modo que varias isoformas podem ser responsáveis pela formação de um determinado metabólito glicuronídeo.
Fatores que alteram o metabolismo dos fármacos.
editarA marca do metabolismo dos fármacos é uma grande variabilidade interindividual que frequentemente leva a acentuadas diferenças na extensão do metabolismo e, consequentemente, na taxa da eliminação do fármaco e outras características de seu perfil de tempo de concentração plasmática. Tal variabilidade é a principal razão pelo qual os pacientes diferem em suas respostas a uma dose padronizada e deve ser considerada ao se estabelecer a posologia ideal para um determinado paciente. Uma associação de fatores genéticos, ambientais e mórbidos altera o metabolismo dos fármacos, com a contribuição relativa de cada um dependendo do fármaco em questão.
Variação genética. Os avanços na biologia molecular mostraram que a diversidade genética é a regra, e não a exceção, para todas as proteínas, incluindo as enzimas que catalisam as reações metabólicas aos fármacos. Em um número crescente dessas enzimas, foram identificadas variações alélicas com atividades catalíticas diferentes da forma selvagem. As diferenças envolvem diversos mecanismos moleculares que acarretam perda completa da atividade, redução da capacidade catalítica ou, no caso de duplicação do gene, aumento da atividade. Além do mais, geralmente esses traços são herdados de modo recessivo autossômico mendeliano e, se forem suficientemente prevalentes, resultam em subpopulações com diferentes capacidades de metabolização de fármacos, i. e., polimorfismo genético. Além disso, a frequência de determinadas variações alélicas muitas vezes varia segundo a ascendência racial do indivíduo. É possível obter o fenótipo ou genótipo de uma pessoa para determinada variação genética e é provável que essa classificação se torne cada vez mais útil para individualização do tratamento farmacológico, especialmente no caso de fármacos com baixo índice terapêutico. Evidências crescentes também sugerem que a sensibilidade individual para doenças associadas a agentes químicos ambientais, como o câncer, pode refletir a variação genética das enzimas que metabolizam os fármacos.
Determinantes ambientais.
A atividade da maioria das enzimas que metabolizam os fármacos pode ser modulada pela exposição a certos compostos exógenos. Em alguns casos, pode tratar-se de um fármaco, que, se administrado concomitantemente com um segundo agente, leva à interação entre os fármacos. Além disso, os micronutrientes da dieta e outros fatores ambientais podem fazer modulação positiva ou negativa das enzimas, denominada indução e inibição, respectivamente. Acredita-se que tal modulação tenha uma contribuição fundamental para a variação interindividual no metabolismo de muitos fármacos.
Principais enzimas e vias
editarDiversas enzimas principais e vias estão envolvidas no metabolismo das drogas, e podem ser divididas em reações de Fase I e Fase II:
Fase I
editarOxidação
editar- Citocromo P450
- Sistema de monooxigenases possuidoras de flavina
- Álcool desidrogenase 6 e Aldeído desidrogenase
- Monoamina oxidase
- Co-oxidação por peroxidases
Redução
editarHidrólise
editarFase II
editarEnzimas que fazem conjugação com proteínas[1]:
- Glutatione transferases
- glicoronato transferases
- N-acetiltransferases
- N-acil aminoácido transferases
- Sulfotransferases
Referências
- ↑ Basic and Clinical Pharmacology (9th Edition; Katzung): 1.4. Drug Biotransformation