Polaridade (química)
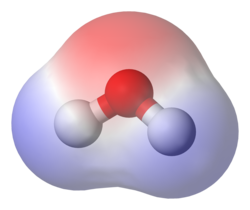
Polaridade, em Química, refere-se à moléculas que apresentam momento de dipolo elétrico, o qual é influenciado pela separação das cargas elétricas e também possuem contribuição de pares de elétrons isolados[1]. Moléculas polares interagem principalmente por forças intermoleculares como dipolos-dipolos ou ligações de hidrogênio. A polaridade molecular depende da diferença de eletronegatividade entre os átomos, assim como a geometria molecular. As ligações de uma molécula podem gerar vetores por causa da diferença de eletronegatividade entre elementos, deslocando pares de elétrons. A geometria da molécula influencia na disposição desses vetores, tendo a possibilidade de se cancelarem ou não. Quando a soma dos vetores se anula, dizemos que o momento de dipolo é igual a zero e a molécula é apolar. Por outro lado, quando o momento de dipolo é diferente de zero, os vetores não se cancelam, resultando em uma molécula polar. Exemplificando, a molécula de água é polar pelo fato de que o oxigênio não compartilha todos os elétrons com o hidrogênio, caracterizando a presença de um par de elétrons desemparelhados. Isso se deve porque os elétrons se concentram mais sobre átomo de Oxigênio, uma vez que ele é muito mais eletronegativo do que os de hidrogênio. Outro exemplo é o metano que é considerado apolar (antônimo de polar) porque o carbono compartilha os elétrons quase uniformemente com os hidrogênios, uma vez que a diferença de eletronegatividade é pouca. Polaridade influi em uma série de propriedades físicas e químicas como tensão superficial, solubilidade, ponto de fusão e ponto de ebulição.
Teoria
editarElétrons não são sempre compartilhados igualmente entre dois átomos que estão fazendo ligações covalentes.[2] No caso de átomos de elementos distintos, geralmente um átomo exerce mais força de atração em uma nuvem eletrônica do que outro.[3][4] Essa força de atração é denominada eletronegatividade e mensura a atração que os átomos exercem sobre os elétrons.[5] Os compartilhamentos desiguais dos elétrons das ligações químicas causam a formação de um dipolo (separação em cargas parciais positivas e negativas) . Cargas parciais são escritas como δ+ (delta mais) e δ-; (delta menos).
Átomos com altas eletronegatividades — assim como flúor, oxigênio, e nitrogênio — exercem um deslocamento muito forte de elétrons das ligações para si próprios[6] quando ligados a átomos com baixas eletronegatividades – como hidrogênio e carbono — podendo acarretar desta forma um compartilhamento desigual entre os átomos e formando polos na molécula.
As ligações podem ser em um dos dois extremos — completamente apolar e completamente polar. Uma ligação completamente apolar ocorre quando as eletronegatividades são idênticas, desta forma o valor da diferença é zero. Uma ligação completamente polar é mais corretamente denominada como ligação iônica[7] e ocorre quando a diferença entre as eletronegatividades são grandes o suficiente para que um átomo retire um elétron do outro. O termo polar e apolar se refere a habilidade das ligações químicas de atraírem cargas elétricas. Para determinar a polaridade de uma ligação covalente, é necessário fazer a diferença de eletronegatividade entre os átomos que forem escolhidos.[8] Se o resultado ficar entre 0,4 e 1,7 a ligação é, em geral, covalente polar.
Polaridade das moléculas
editarÉ importante observar que a polaridade é relativa, ou seja, uma molécula é “mais polar” ou “mais apolar” do que outra de referência.
Moléculas polares
editarUm dos exemplos mais comuns de moléculas polares é a de açúcar, mais exatamente a sacarose, que é uma variedade de açúcar. Açúcares têm muitos grupos oxigênio-hidrogênio (OH) e por isso são muito polares. Quando comparamos substâncias polares e apolares de massas molares parecidas, as moléculas polares em geral têm um ponto de ebulição mais alto, isso se dá pelo fato de haver uma interação dipolo-dipolo entre as moléculas polares. Nas ligações de hidrogênio esse efeito é observado. Pelo fato da natureza da molécula de água ser bastante polar, substâncias polares podem ser dissolvidas nela.
- Exemplo 1. A molécula de ácido fluorídrico, HF, é polar pela ligação entre o hidrogênio e o flúor, nesta ligação covalente os elétrons são mais deslocados para o átomo de flúor criando pólos na molécula.
- Exemplo 2. Na molécula de amônia, as três ligações N–H têm a mesma polaridade (elétrons deslocados dos hidrogênios para o nitrogênio). A molécula possui um par de elétrons que se situam no ápice do nitrogênio e que conferem à molécula um a geometria de pirâmide. Esse par de elétrons não participam de uma ligação covalente, desta forma essa região da molécula é rica em elétrons e resulta um poderoso dipolo por toda a molécula de amônia.
-
Ácido fluorídrico: o átomo de flúor mais eletronegativo é mostrado em amarelo.
-
Ácido fluorídrico: vermelho representa a região de carga parcial negativa.
-
Amônia: o par de elétrons não ligantes são mostrados em amarelo. Os átomos de hidrogênio estão em branco.
-
Ammonia: vermelho representa a região de carga parcial negativa.
Moléculas apolares
editarA molécula pode ser apolar por dois motivos: as polaridades das ligações são quase nulas (quando há um compartilhamento igual dos elétrons entre diferentes átomos) ou porque as ligações polares estão dispostas na molécula de tal forma que os vetores polaridade se anulam.
Exemplos mais comuns de compostos apolares são as gorduras, óleos e gasolina. Portanto, moléculas apolares são insolúveis em água à temperatura ambiente. Contudo, muitos solventes orgânicos apolares, assim como a terebintina, podem dissolver substâncias apolares.
- Exemplo 3. Na molécula de metano as quatro ligações C–H estão dispostas na geometria tetraédrica em volta do átomo carbono. Cada ligação não tem polaridade muito forte. Além do mais, as ligações são dispostas simetricamente de forma que os vetores polaridade de ligação se anulem e por isso não há dipolos na molécula.
- Exemplo 4. A molécula de trifluoreto de boro possui três ligações fortemente polares entre o Boro e o Flúor dispostas em uma geometria trigonal plana a 120° uma ligação da outra mais próxima. Essa disposição confere uma apolaridade à molécula.
- Exemplo 5. A molécula de oxigênio não possui polaridade nas suas ligações porque a eletronegatividade dos átomos são iguais , por consequência não há polaridade na molécula.
-
Metano: as ligações estão dispostas simetricamente, portanto não há polaridade na molécula. Moléculas de Hidrogênio representadas em branco.
-
trifluoreto de boro: arranjo trigonal plano das três ligações polares, que resultam em uma molécula apolar.
Moléculas híbridas
editarSurfactantes reduzem a tensão superficial se adsorvendo na interface água-óleo. Esses compostos podem auxiliar na formação de emulsões estáveis ou misturas de óleos com água. A boa interação com substâncias polares e apolares se dá pelos tipos de forças intermoleculares envolvidas e por questões energéticas como a entropia.
-
Esta molécula complexa possui alguns grupos hidrofílicos em seu lado direito e uma longa cadeia carbônica lipofílica em seu lado esquerdo. Essas características o tornam um surfactante.
-
A micela — Representação de uma micela, onde a longa cadeia lipofílica fica voltada para dentro e dissolve óleos, a parte hidrofílica fica voltada para fora e interage com substâncias polares como a água.
Ver também
editarReferências
- ↑ Mcmurry, John (2016). Química orgânica - vol. I. [S.l.]: Cengage Learning. p. São Paulo. 784 páginas
- ↑ Sherwood, Lauralee. Fundamentals of Physiology: A Human Perspective. 3ª edi. Cengage Learning, 2005. pp. 7. ISBN 1111795061
- ↑ Barrow, John D.; Tipler, Frank J.. The anthropic cosmological principle. Edi. ilustrada. Oxford University Press, 1986. pp. 300. ISBN 0198519494
- ↑ McGraw-Hill Book Company. McGraw-Hill encyclopedia of science & technology. 6ª edi. McGraw-Hill, 1987. pp. 303. ISBN 0070792925
- ↑ Nathan, Sundar. AP Biology Study Guide AP Biology Study Guide. FastPencil Inc, 2009. ISBN 1607468867
- ↑ S. Suthersan, Suthan; C. Payne, Fred. In Situ Remediation Engineering. CRC Press, 2013. pp. 42. ISBN 0203492161
- ↑ Cecie Starr, Ralph Taggart, Christine Evers, Lisa Starr. Biology: The Unity and Diversity of Life. 13ª edi. Cengage Learning, 2012. pp. 28. ISBN 1133707610
- ↑ Bhushan, Bharat. Modern Tribology Handbook, Two Volume Set. Edi. ilustrada. CRC Press, 2010. pp. 912. ISBN 0849377870