Fosfato de dinucleótido de nicotinamida e adenina
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. (Dezembro de 2008) |
| Fosfato de dinucleótido de nicotinamida e adenina Alerta sobre risco à saúde | |
|---|---|
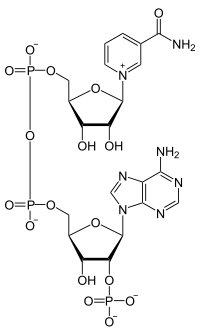
| |
| Identificadores | |
| Número CAS | |
| PubChem | |
| MeSH | |
| Propriedades | |
| Fórmula molecular | C21H29N7O17P3 |
| Massa molar | 744.413 |
| Solubilidade em água | solúvel[1] |
| Riscos associados | |
| Frases R | R36/37/38 |
| Frases S | S26, S36 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A nicotinamida adenina dinucleótido fosfato ou fosfato de dinucleotídeo de adenina e nicotinamida (NADP), ou, em notação mais antiga, TPN (triphosphopyridine nucleotide, nucleotídeo de trifosfopiridina), é uma coenzima semelhante à nicotinamida adenina dinucleótido. É o aceptor de elétrons nas reações da via das pentoses-fosfato e na transformação de malato em piruvato pela ação da enzima málica, havendo redução de NADP+ a NADPH. É um cofator usado em reações anabólicas, tais como o ciclo de Calvin e síntese de lípidos e ácidos nucleicos, a qual requer NADPH como um agente redutor. É usado por todas as formas de vida celular.[2]
Está envolvida nas vias de síntese de ácidos graxos e glicerol.[3][4]
NADPH é forma reduzida de NADP+. NADP+ difere de NAD+ na presença de um grupo fosfato adicional na posição 2' do anel ribose que transporta o grupamento adenina. Este fosfato extra é adicionado por NAD+ quinase e removido por NADP+ fosfatase.[5]
Biossíntese
editarNADP+
editarEm geral, NADP+ é sintetizado antes de NADPH ser. Essa reação geralmente começa com NAD+ a partir de novo caminho ou por caminho de resgate, com NAD+ quinase adicionando o grupo fosfato extra. NAD(P)+ nucleosidase permite a síntese de nicotinamida no caminho de resgate, e NADP+ fosfatase pode converter NADPH novamente a NADH mantendo o balanço.[2] Algumas formas de NAD+ quinase, notadamente na mitocôndria, também pode aceitar o NADH para transformá-lo diretamente em NADPH.[6][7] A via procariótica é menos bem compreendida, mas com todas as proteínas semelhantes, o processo deve funcionar de maneira semelhante.[2]
NADPH
editarNADPH é produzido a partir de NADP+. A principal fonte de NADPH em animais e outros organismos não fotossintéticos é a via das pentoses-fosfato, por glicose-6-fosfato desidrogenase (G6PDH) na primeira etapa. A via da pentose fosfato também produz pentose, outra parte importante da NAD(P)H, de glicose. Algumas bactérias também usam G6PDH para a via Entner–Doudoroff, mas a produção de NADPH continua a mesma.[2]
Ferredoxina-NADP redutase, presente em todos os domínios da vida, é uma importante fonte de NADPH em organismos fotossintéticos, incluindo plantas e cianobactérias. Aparece no último passo da cadeia de elétrons das reações de luz da fotossíntese. É usado como poder redutor para as reações biossintéticas no ciclo de Calvin para assimilar o dióxido de carbono e ajudar a transformar o dióxido de carbono em glicose. Tem funções na aceitação de elétrons em outras vias não fotossintéticas, assim como: é necessário na redução de nitrato em amônia para assimilação de plantas no ciclo do nitrogênio e na produção de óleos.[2]
Existem vários outros mecanismos menos conhecidos de geração de NADPH, todos os quais dependem da presença de mitocondria em eucariotos. As principais enzimas nesses processos relacionados ao metabolismo do carbono são isoformas ligadas a NADP de enzima málica, isocitrato deidrogenase (IDH), e glutamato deidrogenase. Nessas reações, NADP+ age como NAD+ em outras enzimas como agente oxidante.[8] O mecanismo da isocitrato desidrogenase parece ser a principal fonte de NADPH nas células adiposas e possivelmente também no fígado.[9] Esses processos também são encontrados em bactérias. As bactérias também podem usar um agente dependente de NADP gliceraldeído 3-fosfate deidrogenase para o mesmo propósito. Como a via da pentose fosfato, essas vias estão relacionadas a partes da glicólise.[2]
NADPH também pode ser gerado por caminhos não relacionados ao metabolismo do carbono. A ferredoxina redutase é um exemplo. Nicotinamida nucleotídeo transidrogenase transfere o hidrogênio entre NAD(P)H e NAD(P)+, e é encontrado nas mitocôndrias eucarióticas e em muitas bactérias. Existem versões que dependem de um gradiente de prótons para trabalhar e outras que não. Alguns organismos anaeróbicos usam NADP+-ligada hidrogenase, rompendo um hidreto de gás hidrogênio para produzir um próton e NADPH.[2]
Função
editarO NADPH fornece os equivalentes redutores para reações biossintéticas e a oxidação-redução envolvido na proteção contra a toxicidade de espécies reativas de oxigênio (abreviadas na literatura em inglês como ROS, reactive oxygen species), permitindo a regeneração de glutationa (GSH).[10] NADPH também é usada por vias anabólicas, tais comos síntese do colesterol e alongamento da cadeia de ácidos graxos.
O sistema NADPH também é responsável por gerar radicais livres nas células imunológicas por NADPH oxidase. Esses radicais são usados para destruir patógenos em um processo denominado explosão respiratória.[11]
Referências
- ↑ Birgit Weinhold, in: Roempp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ a b c d e f g Spaans SK, Weusthuis RA, van der Oost J, Kengen SW (2015). «NADPH-generating systems in bacteria and archaea». Frontiers in Microbiology. 6. 742 páginas. PMC 4518329 . PMID 26284036. doi:10.3389/fmicb.2015.00742
- ↑ Kaneda, Toshi. "Iso- and Anteiso-Fatty Acids in Bacteria: Biosynthesis, Function, and Taxonomic Significance." Microbiological Reviews 55.2 (1991): 288–302
- ↑ Rajendra J. Redkar, Robert D. Locy, Narendra K. Singh; Biosynthetic Pathways of Glycerol Accumulation under Salt Stress in Aspergillus nidulans; Experimental Mycology, Volume 19, Issue 4, 1995, Pages 241-246. ISSN 0147-5975
- ↑ Kawai, S; Murata, K (abril de 2008). «Structure and function of NAD kinase and NADPH phosphatase: key enzymes that regulate the intracellular balance of NAD(H) and NADP(H).». Bioscience, Biotechnology, and Biochemistry. 72 (4): 919–30. PMID 18391451. doi:10.1271/bbb.70738
- ↑ Iwahashi Y, Hitoshio A, Tajima N, Nakamura T (abril de 1989). «Characterization of NADH kinase from Saccharomyces cerevisiae». Journal of Biochemistry. 105 (4): 588–93. PMID 2547755. doi:10.1093/oxfordjournals.jbchem.a122709
- ↑ Iwahashi Y, Nakamura T (junho de 1989). «Localization of the NADH kinase in the inner membrane of yeast mitochondria». Journal of Biochemistry. 105 (6): 916–21. PMID 2549021. doi:10.1093/oxfordjournals.jbchem.a122779
- ↑ Hanukoglu I, Rapoport R (fevereiro–maio de 1995). «Routes and regulation of NADPH production in steroidogenic mitochondria». Endocrine Research. 21 (1-2): 231–41. PMID 7588385. doi:10.3109/07435809509030439
- ↑ Palmer, Michael. «10.4.3 Supply of NADPH for fatty acid synthesis». Metabolism Course Notes. Consultado em 6 de abril de 2012. Arquivado do original em 6 de junho de 2013
- ↑ Rush GF, Gorski JR, Ripple MG, Sowinski J, Bugelski P, Hewitt WR (maio de 1985). «Organic hydroperoxide-induced lipid peroxidation and cell death in isolated hepatocytes». Toxicology and Applied Pharmacology. 78 (3): 473–83. PMID 4049396. doi:10.1016/0041-008X(85)90255-8
- ↑ Ogawa K, Suzuki K, Okutsu M, Yamazaki K, Shinkai S (outubro de 2008). «The association of elevated reactive oxygen species levels from neutrophils with low-grade inflammation in the elderly». Immunity & Ageing. 5. 13 páginas. PMC 2582223 . PMID 18950479. doi:10.1186/1742-4933-5-13