Polimorfismo de nucleotídeo único
Polimorfismo de nucleotídeo único ou polimorfismo de nucleotídeo simples em genética, (em inglês single nucleotide polymorphism; SNP) é uma variação na sequência de DNA que afeta somente uma base (adenina (A), timina (T), citosina (C) ou guanina (G)) na sequência do genoma entre indivíduos de uma espécie ou entre pares de cromossomos de um individuo.[1] Um polimorfismo de nucleotídeo único (SNP /snɪp/; plural /snɪps/) é uma substituição da linha germinativa de um único nucleotídeo em uma posição específica no genoma. Por exemplo, em uma posição de base específica no genoma humano, o nucleotídeo C pode aparecer na maioria dos indivíduos, mas ocorre que em uma minoria de indivíduos, a posição é ocupada por um A. Isso significa que existe um SNP nesta posição específica, e as duas variações de nucleotídeos possíveis — C ou A — são chamadas de alelos para esta posição específica. Um estudo das proteínas relacionados aos mesmos, pode determinar qual forma é a mais original que não sofreu entropia genética e acúmulo de mutações deletérias nas populações ancestrais[2][3][4] e qual forma foi mutada que aparece com maior frequência nas populações atuais.
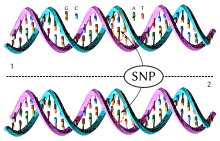
Os SNPs identificam diferenças em nossa suscetibilidade a uma ampla gama de doenças (por exemplo, anemia falciforme, β-talassemia e fibrose cística).[5][6][7] A gravidade da doença e a forma como o corpo responde aos tratamentos também são manifestações de variações genéticas causadas por SNPs. Por exemplo, se uma mutação de base única no gene APOE (apolipoproteína E) está associada a um risco menor de doença de Alzheimer.[8]
Uma variante de nucleotídeo único (SNV) é uma variação em um único nucleotídeo. Os SNVs diferem dos SNPs no sentido de que um SNV pode ser somático[9] e pode ser causado por câncer,[10] mas um SNP deve segregar na população de organismos de uma espécie. Os SNVs também surgem comumente em diagnósticos moleculares, como a criação de primers de PCR para detectar vírus, nos quais a amostra de RNA ou DNA viral pode conter SNVs.
| Tipos de SNPs |
|---|
Polimorfismos de nucleotídeo único podem cair em sequências codificantes de genes, regiões não codificantes de genes ou nas regiões intergênicas (regiões entre genes). SNPs dentro de uma sequência de codificação não alteram necessariamente a sequência de aminoácidos da proteína que é produzida, devido à degenerescência do código genético .
SNPs na região de codificação são de dois tipos: SNPs sinônimos e não-sinônimos. SNPs sinônimos não afetam a sequência da proteína, enquanto SNPs não sinônimos, alteram a sequência de aminoácidos da proteína e podem deixar que ela perca ou diminua sua função.
SNPs em regiões não codificantes podem se manifestar em um risco maior de câncer,[11] e podem afetar a estrutura do mRNA e a suscetibilidade à doença.[12] SNPs não codificantes também podem alterar o nível de expressão de um gene, como um eQTL (locus de traço quantitativo de expressão).
SNPs em regiões de codificação
editarSNPs em regiões de codificação podem ser classificadas em:
- Missense — mudança única na base resulta em mudança no aminoácido da proteína e seu mau funcionamento que leva à doença (por exemplo, c1580G> T SNP no gene LMNA - posição 1580 (nt) na sequência de DNA (códon CGT) fazendo com que a guanina seja substituída com a timina, produzindo o códon CTT na sequência de DNA, resulta no nível da proteína na substituição da arginina pela leucina na posição 527,[13] no nível do fenótipo, isso se manifesta na displasia mandibuloacral sobreposta e na síndrome da progéria ) Neste tipo de mutações há uma alteração de uma das bases do DNA, de tal forma que o tripleto de nucleótidos da qual ela faz parte se altera, passando a codificar um aminoácido incorreto (diferente do que seria esperado na posição correspondente da proteína). A mutação missense pode alterar a função da proteína em maior ou menor grau, dependendo da localização e da importância do específico aminoácido.
- Nonsense — mutação pontual em uma sequência de DNA que resulta em um códon de parada prematuro, ou um códon sem sentido no mRNA transcrito, e em um produto de proteína truncado, incompleto e geralmente não funcional (por exemplo Fibrose cística causada pela mutação G542X no gene regulador da condutância transmembrana da fibrose cística).[14] SNPs que não estão em regiões codificadoras de proteínas, ainda podem afetar o splicing do gene (Crabtree), a ligação do fator de transcrição, a degradação do RNA mensageiro ou a sequência de RNA não codificador. A expressão gênica afetada por este tipo de SNP é conhecida como eSNP (expressão do SNP) e pode estar a montante ou a jusante do gene.
Frequência
editarSe mais de 1% da população analisada possui tal polimorfismo de nucleotídeo único eles são chamados SNPs, e for menor que 1% é chamado simplesmente de uma mutação:[15]
"Se mais de 1% de uma população não carrega o mesmo nucleotídeo em uma posição específica na sequência de DNA, então esta variação pode ser classificado como um SNP. Se um SNP ocorre dentro de um gene, o gene é descrito como tendo mais de um alelo. Nestes casos, os SNPs podem levar a variações na sequência de aminoácidos. SNPs, no entanto, não estão apenas associados a genes; eles também podem ocorrer em regiões não codificantes do DNA".
Porém muitas publicações[16][17][18] não aplicam esse limite de frequência, pois mais de 335 milhões de SNPs foram encontrados em humanos de várias populações. Um genoma típico difere do genoma humano de referência em 4 a 5 milhões de locais, a maioria dos quais (mais de 99,9%) consiste em SNPs e indels curtos.[19]
Nestes casos, o termo polimorfismo de nucleotídeo simples é mais adequado.[20] Estas variações devem ocorrer em "no mínimo" 1% de uma determinada população para ser considerada como um SNP. Se, por outro lado, a frequência de uma variação for inferior a 1%, a mesma será considerada simplesmente uma mutação. Assim, por exemplo, dois indivíduos podem apresentar fragmentos de sequência de DNA que diferem por apenas um nucleotídeo GGGG(C)CG e GGGG(T)CG, e diz-se então que existem dois alelos: C e T (Brookes, 1999). Portanto, os SNPs são marcadores bialélicos, podendo ser tri-alélicos (menor frequência).
Encontram-se por toda região do genoma: íntrons, éxons, regiões intergênicas, promotores ou enhancers.[21] A localização do SNP pode ter grande relevância, como por exemplo um SNP encontrado na região codificadora pode alterar a formação de proteínas, assim como um SNP intrônico pode influenciar no splicing do mRNA.[21]
Dentro de um genoma
editarA distribuição genômica dos SNPs não é homogênea; SNPs ocorrem em regiões não codificantes com mais frequência do que em regiões codificantes ou, isso se deve ao número de interações maior, espaço ocupado maior, vulnerabilidade maior e consequentemente a seleção natural estará agindo e "fixando" o alelo (eliminando outras variantes) do SNP que constitui a adaptação genética mais favorável.[22] Outros fatores, como recombinação genética e taxa de mutação, podem determinar a densidade SNP.[23]
A densidade SNP pode ser prevista pela presença de microssatélites: microssatélites AT em particular são potentes preditores de densidade SNP, com longos tratos de repetição (AT) (n) tendendo a ser encontrados em regiões de densidade SNPs significativamente reduzida e baixo conteúdo de GC.[24]
Dentro de uma população
editarExistem variações entre as populações humanas, portanto, um alelo SNP comum em um grupo geográfico ou étnico, pode ser muito mais raro em outro. Em uma população, os SNPs podem ser atribuídos a uma frequência de alelo menor — a frequência de alelo mais baixa em um locus que é observado em uma população particular.[25] Esta é simplesmente a menor das duas frequências de alelos para polimorfismos de nucleotídeo único.
Com esse conhecimento, os cientistas desenvolveram novos métodos de análise de estruturas populacionais em espécies menos estudadas.[26][27][28][29] Ao usar técnicas de "pooling", o custo da análise é reduzido significativamente. Essas técnicas são baseadas no sequenciamento de uma população em uma amostra combinada em vez de sequenciar cada indivíduo dentro da população por si só. "O pooling permite que as frequências de alelos em grupos de indivíduos sejam medidas usando muito menos reações de PCR e ensaios de genotipagem do que os usados na genotipagem de indivíduo".
Com as novas ferramentas de bioinformática, existe a possibilidade de investigar a estrutura da população, o fluxo gênico e a migração gênica, observando as frequências alélicas em toda a população. Com estes protocolos existe a possibilidade de combinar as vantagens dos SNPs com marcadores de micro satélites.[30][31] No entanto, existem informações perdidas no processo, como desequilíbrio de ligação e informações de zigosidade.
Possuem diversas vantagens em relação aos demais marcadores, sendo elas: sua estabilidade, alta frequência e facilidade de automatização.[21]
Os SNPs constituem 90% de todas as variações genômicas humanas e aparecem, em média, uma vez a cada 1.300 bases, ao longo do genoma humano. Dois terços dos SNP correspondem a substituições de uma citosina (C) por uma timina (T).
Aplicações
editar- Os estudos de associação podem determinar se uma variante genética está associada a uma doença ou característica.[32]
- Um tag SNP é um polimorfismo de nucleotídeo único representativo em uma região do genoma com alto desequilíbrio de ligação (a associação não aleatória de alelos em dois ou mais loci). Tag SNPs são úteis em estudos de associação de SNPs de genoma completo, nos quais centenas de milhares de SNPs em todo o genoma são genotipados.
- Mapeamento de haplótipos: conjuntos de alelos ou sequências de DNA podem ser agrupados de modo que um único SNP possa identificar muitos SNPs vinculados.
- O desequilíbrio de ligação (LD), um termo usado na genética de populações, indica associação não aleatória de alelos em dois ou mais loci, não necessariamente no mesmo cromossomo. Refere-se ao fenômeno de que o alelo SNP ou a sequência de DNA que estão próximos no genoma tendem a ser herdados juntos. O LD pode ser afetado por dois parâmetros (entre outros fatores, como estratificação da população): 1) A distância entre os SNPs [quanto maior a distância, menor o LD]. 2) Taxa de recombinação [quanto menor a taxa de recombinação, maior o LD].[33]
Os SNPs apresentam baixa taxa de mutação, sendo assim, podem ser utilizados como marcadores genéticos para seguir padrões de herança das regiões cromossômicas de geração em geração[34] e por este motivo são ótimos marcadores de ancestralidade. Tem desempenhado importante papel em estudos filogeográficos e filogenéticos,[35] além de serem ferramentas poderosas no estudo de fatores genéticos associados a doenças humanas e úteis na farmacogenética, para melhores resultados nas respostas a droga.[1][34]
Na identificação de doenças
editarUm único SNP pode causar uma doença de Mendel, embora para doenças complexas, os SNPs geralmente não funcionam individualmente, em vez disso, eles funcionam em coordenação com outros SNPs para manifestar uma doença, como na Osteoporose. Um dos primeiros sucessos nesse campo foi encontrar uma mutação de base única na região não codificadora do APOC3 (gene da apolipoproteína C3) associada a riscos mais elevados de hipertrigliceridemia e aterosclerose. Algumas doenças causadas por SNPs incluem a artrite reumatóide, doença de Crohn, cancro da mama, a doença de Alzheimer, e algumas desordens auto-imunes . Estudos de associação em grande escala foram realizados para tentar descobrir SNPs causadores de doenças adicionais em uma população, mas um grande número deles são cada vez mais conhecidos nos bancos de dados, como por exemplo:
- rs6311 e rs6313 são SNPs no gene do receptor 5-HT2A da serotonina no cromossomo 13 humano.[36]
- Um SNP no gene F5 causa trombofilia do Fator V de Leiden.[37]
- rs3091244 é um exemplo de SNP trialélico no gene CRP no cromossomo humano 1.[38]
- Códigos TAS2R38 para capacidade de degustação PTC e contém 6 SNPs anotados.[39]
- rs148649884 e rs138055828 no gene FCN1 que codifica a M-ficolina prejudicou a capacidade de ligação ao ligante da M-ficolina recombinante.[40]
- Um SNP intrônico no gene de reparo de incompatibilidade de DNA PMS2 (rs1059060, Ser775Asn) está associado ao aumento dos danos ao DNA do esperma e ao risco de infertilidade masculina .[41]
Banco de Dados
editarComo existem para genes, existem bancos de dados de bioinformática para SNPs.
- dbSNP é um banco de dados SNP do National Center for Biotechnology Information (NCBI). Desde 8 de junho de 2015[update], dbSNP listou 149.735.377 SNPs em humanos.[42][43]
- Kaviar[44] é um compêndio de SNPs de várias fontes de dados, incluindo dbSNP.
- SNPedia é um banco de dados no estilo wiki que oferece suporte à anotação, interpretação e análise do genoma pessoal.
- O banco de dados OMIM descreve a associação entre polimorfismos e doenças (por exemplo, fornece doenças na forma de texto)
- dbSAP - banco de dados de polimorfismo de aminoácido único para detecção de variação de proteína[45]
- O banco de dados de mutações genéticas humanas fornece mutações genéticas que causam ou estão associadas a doenças hereditárias humanas e SNPs funcionais
- O International HapMap Project, onde os pesquisadores estão identificando Tag SNPs para poderem determinar a coleção de haplótipos presentes em cada sujeito.
- O GWAS Central permite que os usuários interroguem visualmente os dados reais de associação de nível de resumo em um ou mais estudos de associação de todo o genoma .
O grupo de trabalho International SNP Map mapeou a sequência que estabelece cada SNP por alinhamento com a sequência genômica de clones de inserção grande no Genebank. Esses alinhamentos foram convertidos em coordenadas cromossômicas que são mostradas na Tabela 1.[46] Essa lista aumentou muito desde, por exemplo, o banco de dados Kaviar agora listando 162 milhões de variantes de nucleotídeo único (SNVs).
| Total SNPs | kb per SNP | Total SNPs | kb per SNP | ||
| 1 | 214,066,000 | 129,931 | 1.65 | 75,166 | 2.85 |
| 2 | 222,889,000 | 103,664 | 2.15 | 76,985 | 2.90 |
| 3 | 186,938,000 | 93,140 | 2.01 | 63,669 | 2.94 |
| 4 | 169,035,000 | 84,426 | 2.00 | 65,719 | 2.57 |
| 5 | 170,954,000 | 117,882 | 1.45 | 63,545 | 2.69 |
| 6 | 165,022,000 | 96,317 | 1.71 | 53,797 | 3.07 |
| 7 | 149,414,000 | 71,752 | 2.08 | 42,327 | 3.53 |
| 8 | 125,148,000 | 57,834 | 2.16 | 42,653 | 2.93 |
| 9 | 107,440,000 | 62,013 | 1.73 | 43,020 | 2.50 |
| 10 | 127,894,000 | 61,298 | 2.09 | 42,466 | 3.01 |
| 11 | 129,193,000 | 84,663 | 1.53 | 47,621 | 2.71 |
| 12 | 125,198,000 | 59,245 | 2.11 | 38,136 | 3.28 |
| 13 | 93,711,000 | 53,093 | 1.77 | 35,745 | 2.62 |
| 14 | 89,344,000 | 44,112 | 2.03 | 29,746 | 3.00 |
| 15 | 73,467,000 | 37,814 | 1.94 | 26,524 | 2.77 |
| 16 | 74,037,000 | 38,735 | 1.91 | 23,328 | 3.17 |
| 17 | 73,367,000 | 34,621 | 2.12 | 19,396 | 3.78 |
| 18 | 73,078,000 | 45,135 | 1.62 | 27,028 | 2.70 |
| 19 | 56,044,000 | 25,676 | 2.18 | 11,185 | 5.01 |
| 20 | 63,317,000 | 29,478 | 2.15 | 17,051 | 3.71 |
| 21 | 33,824,000 | 20,916 | 1.62 | 9,103 | 3.72 |
| 22 | 33,786,000 | 28,410 | 1.19 | 11,056 | 3.06 |
| X | 131,245,000 | 34,842 | 3.77 | 20,400 | 6.43 |
| Y | 21,753,000 | 4,193 | 5.19 | 1,784 | 12.19 |
| RefSeq | 15,696,674 | 14,534 | 1.08 | ||
| Totals | 2,710,164,000 | 1,419,190 | 1.91 | 887,450 | 3.05 |
Na Pesquisa Clínica
editarVariações nas sequências de DNA de humanos, em geral podem afetar o modo como os humanos desenvolvem doenças, e respondem a patógenos, produtos químicos, drogas, vacinas e outros agentes. Os SNPs também são essenciais para a medicina personalizada.[47] Os exemplos incluem pesquisa biomédica, forense, farmacogenética e causalidade de doenças, conforme descrito abaixo.
A maior importância dos SNPs na pesquisa clínica, é a comparação de regiões do genoma entre coortes (como coortes correspondentes com e sem doença) em estudos de associação de todo o genoma. SNPs têm sido usados em estudos de associação do genoma como marcadores de alta resolução no mapeamento de genes relacionados a doenças ou traços normais.[48] SNPs sem um impacto observável no fenótipo (as chamadas mutações silenciosas) ainda são úteis como marcadores genéticos, em estudos de associação do genoma, por causa de sua quantidade e da herança estável ao longo das gerações.[49]
Os SNPs têm sido usados historicamente para comparar uma amostra de DNA forense a um suspeito, mas tornaram-se obsoletos devido ao avanço das técnicas de impressão digital de DNA baseadas em STR No entanto, o desenvolvimento da tecnologia de sequenciamento de próxima geração (NGS) pode permitir mais oportunidades para o uso de SNPs em pistas fenotípicas, como etnia, cor do cabelo e cor dos olhos com uma boa probabilidade de correspondência. Isso também pode ser aplicado para aumentar a precisão das reconstruções faciais, fornecendo informações que podem ser desconhecidas, e essas informações podem ser usadas para ajudar a identificar suspeitos, mesmo sem uma correspondência de perfil de DNA de STR.
Farmacogenética
editarAlguns SNPs estão associados ao metabolismo de diferentes drogas.[50][51] Os SNP podem ser mutações, como deleções, que podem inibir ou promover a atividade enzimática; tal mudança na atividade enzimática pode levar à diminuição das taxas de metabolismo de drogas[52] A associação de uma ampla gama de doenças humanas como câncer, doenças infecciosas (aids, hanseníase, hepatite, etc.) autoimunes, neuropsiquiátricas e muitas outras doenças com diferentes SNPs podem ser feitos como alvos farmacogenômicos relevantes para a terapia medicamentosa.[53] Os SNPs apresentam baixa taxa de mutação, sendo assim, podem ser utilizados como marcadores genéticos para seguir padrões de herança das regiões cromossômicas de geração em geração[54] e por este motivo são ótimos marcadores de ancestralidade. Tem desempenhado importante papel em estudos filogeográficos e filogenéticos,[55] além de serem ferramentas poderosas no estudo de fatores genéticos associados a doenças humanas e úteis na farmacogenética, para melhores resultados nas respostas a droga.[1][54]
Na Investigação Forence
editarOs SNPs têm sido usados historicamente para comparar uma amostra de DNA forense a um suspeito, mas tornaram-se obsoletos devido ao avanço das técnicas de impressão digital de DNA baseadas em STR. No entanto, o desenvolvimento da tecnologia de sequenciamento de próxima geração (NGS) pode permitir mais oportunidades para o uso de SNPs em pistas fenotípicas, como etnia, cor do cabelo e cor dos olhos com uma boa probabilidade de correspondência. Isso também pode ser aplicado para aumentar a precisão das reconstruções faciais, fornecendo informações que podem ser desconhecidas, e essas informações podem ser usadas para ajudar a identificar suspeitos, mesmo sem uma correspondência de perfil de DNA de STR. Alguns contras de usar SNPs versus STRs é que SNPs produzem menos informações do que STRs e, portanto, mais SNPs são necessários para análise antes que um perfil de um suspeito seja criado. Além disso, os SNPs dependem fortemente da presença de um banco de dados para análise comparativa de amostras. No entanto, em casos com amostras degradadas ou de pequeno volume, as técnicas SNP são uma excelente alternativa aos métodos STR. SNPs (em oposição a STRs) têm uma abundância de marcadores potenciais, podem ser totalmente automatizados e uma possível redução do comprimento do fragmento necessário para menos de 100 bp.
Nomenclatura
editarA nomenclatura para SNPs inclui várias variações para um SNP individual, embora falte um consenso comum. O padrão rs ### é aquele que vem sendo adotado pelo dbSNP e usa o prefixo "rs", para "referência SNP", seguido por um número único e arbitrário.[56] Os SNPs são frequentemente referidos por seu número dbSNP rs, como nos exemplos acima. A Human Genome Variation Society (HGVS) usa um padrão que transmite mais informações sobre o SNP. Exemplos são:
- c.76A > T: "c." para a região de codificação, seguido por um número para a posição do nucleotídeo, seguido por uma abreviatura de uma letra para o nucleotídeo (A, C, G, T ou U), seguido por um sinal maior que (">") para indicar substituição, seguida pela abreviatura do nucleotídeo que substitui o anterior.[57][58][59]
- p. Ser123Arg: "p." para proteína, seguida por uma abreviatura de três letras para o aminoácido, seguida por um número para a posição do aminoácido, seguido pela abreviatura do aminoácido que substitui o primeiro.[60]
Análise de SNPs
editarSNPs podem ser facilmente testados devido a conter apenas dois alelos possíveis e três genótipos possíveis envolvendo os dois alelos: homozigoto A, homozigoto B e heterozigoto AB, levando a muitas técnicas possíveis para análise. Alguns incluem: sequenciamento de DNA; eletroforese capilar; espectrometria de massa; polimorfismo de conformação de fita simples (SSCP); extensão de base única; análise eletroquímica; HPLC desnaturante e eletroforese em gel; polimorfismo do comprimento do fragmento de restrição; e análise de hibridização.
Programas para previsão de efeitos SNP
editarUm grupo importante de SNPs são aqueles que correspondem a mutações missense que causam alterações de aminoácidos no nível de proteína. A mutação pontual de determinado resíduo pode ter efeito diferente na função da proteína (de nenhum efeito até a interrupção completa de sua função). Normalmente, a mudança em aminoácidos com tamanho e propriedades físico-químicas semelhantes (por exemplo, substituição de leucina por valina) tem efeito moderado e oposto. Da mesma forma, se o SNP interrompe os elementos da estrutura secundária (por exemplo, substituição por prolina na região da hélice alfa), essa mutação geralmente pode afetar a estrutura e função da proteína inteira. Usando essas regras simples e muitas outras derivadas do aprendizado de máquina, um grupo de programas para a previsão do efeito SNP foi desenvolvido:[61]
- SIFT Este programa fornece uma visão sobre como uma mutação sem sentido ou não-sinônimo induzida em laboratório afetará a função da proteína com base nas propriedades físicas do aminoácido e na homologia da sequência.
- LIST[62][63] (Identidade Local e Taxa Compartilhada) estima o potencial deletério de mutações resultantes da alteração de suas funções protéicas. É baseado na suposição de que as variações observadas em espécies estreitamente relacionadas são mais significativas ao avaliar a conservação em comparação com aquelas em espécies distantemente relacionadas.
- SNAP2
- Suspeito
- PolyPhen-2
- PredictSNP
- MutationTaster: site oficial
- Preditor de efeito variante do projeto Ensembl
- SNPViz[64] Este programa fornece uma representação 3D da proteína afetada, destacando a mudança de aminoácidos para que os médicos possam determinar a patogenicidade da proteína mutante.
- PROVEAN
- PhyreRisk é um banco de dados que mapeia variantes para estruturas de proteínas experimentais e previstas.[65]
- Missense3D é uma ferramenta que fornece um relatório estereoquímico sobre o efeito de variantes missense na estrutura da proteína.[66]
Referências
- ↑ a b c Santoro, Andreia. Identificação de Single Nucleotide Polymorphisms no gene Nove-cisepoxicarotenóde dioxigenase (NCED) em Eucalyptus / Andréia Santoro. – Botucatu, 2010
- ↑ Hivert, Valentin; Leblois, Raphël; Petit, Eric J.; Gautier, Mathieu; Vitalis, Renaud (20 de março de 2018). «Measuring genetic differentiation from Pool-seq data». dx.doi.org. doi:10.1534/genetics.118.300900. Consultado em 14 de maio de 2021
- ↑ Sanford, John; Brewer, Wesley; Smith, Franzine; Baumgardner, John (17 de setembro de 2015). «The waiting time problem in a model hominin population». Theoretical Biology and Medical Modelling (1). 18 páginas. ISSN 1742-4682. PMC 4573302 . PMID 26376851. doi:10.1186/s12976-015-0016-z. Consultado em 14 de maio de 2021
- ↑ Basener, William F.; Sanford, John C. (1 de junho de 2018). «The fundamental theorem of natural selection with mutations». Journal of Mathematical Biology (em inglês) (7): 1589–1622. ISSN 1432-1416. PMC 5906570 . PMID 29116373. doi:10.1007/s00285-017-1190-x. Consultado em 14 de maio de 2021
- ↑ Ingram VM (outubro de 1956). «A specific chemical difference between the globins of normal human and sickle-cell anaemia haemoglobin». Nature. 178: 792–4. Bibcode:1956Natur.178..792I. PMID 13369537. doi:10.1038/178792a0
- ↑ Chang JC, Kan YW (junho de 1979). «beta 0 thalassemia, a nonsense mutation in man». Proceedings of the National Academy of Sciences of the United States of America. 76: 2886–9. Bibcode:1979PNAS...76.2886C. PMC 383714 . PMID 88735. doi:10.1073/pnas.76.6.2886
- ↑ Hamosh A, King TM, Rosenstein BJ, Corey M, Levison H, Durie P, Tsui LC, McIntosh I, Keston M, Brock DJ (agosto de 1992). «Cystic fibrosis patients bearing both the common missense mutation Gly----Asp at codon 551 and the delta F508 mutation are clinically indistinguishable from delta F508 homozygotes, except for decreased risk of meconium ileus». American Journal of Human Genetics. 51: 245–50. PMC 1682672 . PMID 1379413
- ↑ Wolf AB, Caselli RJ, Reiman EM, Valla J (abril de 2013). «APOE and neuroenergetics: an emerging paradigm in Alzheimer's disease». Neurobiology of Aging. 34: 1007–17. PMC 3545040 . PMID 23159550. doi:10.1016/j.neurobiolaging.2012.10.011
- ↑ «SNVMix: predicting single nucleotide variants from next-generation sequencing of tumors». PMID 20130035
- ↑ Khurana, Ekta; Fu, Yao; Chakravarty, Dimple; Demichelis, Francesca; Rubin, Mark A.; Gerstein, Mark (19 de janeiro de 2016). «Role of non-coding sequence variants in cancer». Nature Reviews Genetics. 17: 93–108. ISSN 1471-0056. PMID 26781813. doi:10.1038/nrg.2015.17
- ↑ Li G, Pan T, Guo D, Li LC (2014). «Regulatory Variants and Disease: The E-Cadherin -160C/A SNP as an Example». Molecular Biology International. 2014. 967565 páginas. PMC 4167656 . PMID 25276428. doi:10.1155/2014/967565
- ↑ Lu YF, Mauger DM, Goldstein DB, Urban TJ, Weeks KM, Bradrick SS (novembro de 2015). «IFNL3 mRNA structure is remodeled by a functional non-coding polymorphism associated with hepatitis C virus clearance». Scientific Reports. 5. 16037 páginas. Bibcode:2015NatSR...516037L. PMC 4631997 . PMID 26531896. doi:10.1038/srep16037
- ↑ Al-Haggar M, Madej-Pilarczyk A, Kozlowski L, Bujnicki JM, Yahia S, Abdel-Hadi D, Shams A, Ahmad N, Hamed S, Puzianowska-Kuznicka M (novembro de 2012). «A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome». European Journal of Human Genetics. 20: 1134–40. PMC 3476705 . PMID 22549407. doi:10.1038/ejhg.2012.77
- ↑ Cordovado SK, Hendrix M, Greene CN, Mochal S, Earley MC, Farrell PM, Kharrazi M, Hannon WH, Mueller PW (fevereiro de 2012). «CFTR mutation analysis and haplotype associations in CF patients». Molecular Genetics and Metabolism. 105: 249–54. PMC 3551260 . PMID 22137130. doi:10.1016/j.ymgme.2011.10.013
- ↑ «single-nucleotide polymorphism / SNP | Learn Science at Scitable». www.nature.com. Consultado em 13 de novembro de 2015. Cópia arquivada em 10 de novembro de 2015
- ↑ «dbSNP—Database for Single Nucleotide Polymorphisms and Other Classes of Minor Genetic Variation». PMID 10447503
- ↑ «Initial sequencing and analysis of the human genome». PMID 11237011
- ↑ «A global reference for human genetic variation». PMID 26432245
- ↑ Auton A, Brooks LD, Durbin RM, Garrison EP, Kang HM, Korbel JO, Marchini JL, McCarthy S, McVean GA, Abecasis GR (2015). «A global reference for human genetic variation». Nature. 526: 68–74. Bibcode:2015Natur.526...68T. PMC 4750478 . PMID 26432245. doi:10.1038/nature15393
- ↑ Gibson & Muse. A Primer of Genome Science, 2nd Edition. Sinauer Associates. 2004
- ↑ a b c Martin, Leonardo Curi. Identificação de SNPs (Single Nucleotide Polymorphisms) no gene colina monooxigenase relacionado ao metabolismo da glicina betaína em Eucalyptus / Leonardo Curi Martin. – Botucatu, 2010
- ↑ Barreiro LB, Laval G, Quach H, Patin E, Quintana-Murci L (março de 2008). «Natural selection has driven population differentiation in modern humans». Nature Genetics. 40: 340–5. PMID 18246066. doi:10.1038/ng.78
- ↑ Nachman MW (setembro de 2001). «Single nucleotide polymorphisms and recombination rate in humans». Trends in Genetics. 17: 481–5. PMID 11525814. doi:10.1016/S0168-9525(01)02409-X
- ↑ Varela MA, Amos W (março de 2010). «Heterogeneous distribution of SNPs in the human genome: microsatellites as predictors of nucleotide diversity and divergence». Genomics. 95: 151–9. PMID 20026267. doi:10.1016/j.ygeno.2009.12.003
- ↑ Zhu Z, Yuan D, Luo D, Lu X, Huang S (24 de julho de 2015). «Enrichment of Minor Alleles of Common SNPs and Improved Risk Prediction for Parkinson's Disease». PLOS ONE. 10: e0133421. Bibcode:2015PLoSO..1033421Z. PMC 4514478 . PMID 26207627. doi:10.1371/journal.pone.0133421
- ↑ Hivert, Valentin; Leblois, Raphaël; Petit, Eric J.; Gautier, Mathieu; Vitalis, Renaud (30 de julho de 2018). «Measuring Genetic Differentiation from Pool-seq Data». Genetics. 210: 315–330. ISSN 0016-6731. PMC 6116966 . PMID 30061425. doi:10.1534/genetics.118.300900
- ↑ Ekblom, R; Galindo, J (8 de dezembro de 2010). «Applications of next generation sequencing in molecular ecology of non-model organisms». Heredity. 107: 1–15. ISSN 0018-067X. PMC 3186121 . PMID 21139633. doi:10.1038/hdy.2010.152
- ↑ Ellegren, Hans (janeiro de 2014). «Genome sequencing and population genomics in non-model organisms». Trends in Ecology & Evolution. 29: 51–63. ISSN 0169-5347. PMID 24139972. doi:10.1016/j.tree.2013.09.008
- ↑ Sanford, John; Brewer, Wesley; Smith, Franzine; Baumgardner, John (17 de setembro de 2015). «The waiting time problem in a model hominin population». Theoretical Biology and Medical Modelling (1). 18 páginas. ISSN 1742-4682. PMC 4573302 . PMID 26376851. doi:10.1186/s12976-015-0016-z. Consultado em 14 de maio de 2021
- ↑ Dorant, Yann; Benestan, Laura; Rougemont, Quentin; Normandeau, Eric; Boyle, Brian; Rochette, Rémy; Bernatchez, Louis (2019). «Comparing Pool-seq, Rapture, and GBS genotyping for inferring weak population structure: The American lobster (Homarus americanus) as a case study». Ecology and Evolution (em inglês). 9: 6606–6623. ISSN 2045-7758. PMC 6580275 . PMID 31236247. doi:10.1002/ece3.5240
- ↑ Vendrami, David L. J.; Telesca, Luca; Weigand, Hannah; Weiss, Martina; Fawcett, Katie; Lehman, Katrin; Clark, M. S.; Leese, Florian; McMinn, Carrie (2017). «RAD sequencing resolves fine-scale population structure in a benthic invertebrate: implications for understanding phenotypic plasticity». Royal Society Open Science. 4. 160548 páginas. Bibcode:2017RSOS....460548V. PMC 5367306 . PMID 28386419. doi:10.1098/rsos.160548
- ↑ Zhang K, Qin ZS, Liu JS, Chen T, Waterman MS, Sun F (maio de 2004). «Haplotype block partitioning and tag SNP selection using genotype data and their applications to association studies». Genome Research. 14: 908–16. PMC 479119 . PMID 15078859. doi:10.1101/gr.1837404
- ↑ Gupta PK, Roy JK, Prasad M (25 de fevereiro de 2001). «Single nucleotide polymorphisms: a new paradigm for molecular marker technology and DNA polymorphism detection with emphasis on their use in plants». Current Science. 80: 524–535. Cópia arquivada em 13 de fevereiro de 2017
- ↑ a b Pui-Yan Kwok, Xiangning Chen (2003). «Detection of Single Nucleotide Polymorphisms» (PDF). Curr. Issues Mol. Biol.
- ↑ Adam D. Leache, Jamie R. Oaks (2017). «The Utility of Single Nucleotide Polymorphism (SNP) Data in Phylogenetics». Annual Review of Ecology, Evolution, and Systematics
- ↑ Giegling I, Hartmann AM, Möller HJ, Rujescu D (novembro de 2006). «Anger- and aggression-related traits are associated with polymorphisms in the 5-HT-2A gene». Journal of Affective Disorders. 96: 75–81. PMID 16814396. doi:10.1016/j.jad.2006.05.016
- ↑ Kujovich JL (janeiro de 2011). «Factor V Leiden thrombophilia». Genetics in Medicine. 13: 1–16. PMID 21116184. doi:10.1097/GIM.0b013e3181faa0f2
- ↑ Morita A, Nakayama T, Doba N, Hinohara S, Mizutani T, Soma M (junho de 2007). «Genotyping of triallelic SNPs using TaqMan PCR». Molecular and Cellular Probes. 21: 171–6. PMID 17161935. doi:10.1016/j.mcp.2006.10.005
- ↑ Prodi DA, Drayna D, Forabosco P, Palmas MA, Maestrale GB, Piras D, Pirastu M, Angius A (outubro de 2004). «Bitter taste study in a sardinian genetic isolate supports the association of phenylthiocarbamide sensitivity to the TAS2R38 bitter receptor gene». Chemical Senses. 29: 697–702. PMID 15466815. doi:10.1093/chemse/bjh074
- ↑ Ammitzbøll CG, Kjær TR, Steffensen R, Stengaard-Pedersen K, Nielsen HJ, Thiel S, Bøgsted M, Jensenius JC (28 de novembro de 2012). «Non-synonymous polymorphisms in the FCN1 gene determine ligand-binding ability and serum levels of M-ficolin». PLOS ONE. 7: e50585. Bibcode:2012PLoSO...750585A. PMC 3509001 . PMID 23209787. doi:10.1371/journal.pone.0050585
- ↑ Ji G, Long Y, Zhou Y, Huang C, Gu A, Wang X (maio de 2012). «Common variants in mismatch repair genes associated with increased risk of sperm DNA damage and male infertility». BMC Medicine. 10. 49 páginas. PMC 3378460 . PMID 22594646. doi:10.1186/1741-7015-10-49
- ↑ National Center for Biotechnology Information, United States National Library of Medicine. 2014. NCBI dbSNP build 142 for human. «[DBSNP-announce] DBSNP Human Build 142 (GRCh38 and GRCh37.p13)». Consultado em 11 de setembro de 2017. Cópia arquivada em 10 de setembro de 2017
- ↑ National Center for Biotechnology Information, United States National Library of Medicine. 2015. NCBI dbSNP build 144 for human. Summary Page. «DBSNP Summary». Consultado em 11 de setembro de 2017. Cópia arquivada em 10 de setembro de 2017
- ↑ Glusman G, Caballero J, Mauldin DE, Hood L, Roach JC (novembro de 2011). «Kaviar: an accessible system for testing SNV novelty». Bioinformatics. 27: 3216–7. PMC 3208392 . PMID 21965822. doi:10.1093/bioinformatics/btr540
- ↑ Cao R, Shi Y, Chen S, Ma Y, Chen J, Yang J, Chen G, Shi T (janeiro de 2017). «dbSAP: single amino-acid polymorphism database for protein variation detection». Nucleic Acids Research. 45: D827–D832. PMC 5210569 . PMID 27903894. doi:10.1093/nar/gkw1096
- ↑ Sachidanandam R, Weissman D, Schmidt SC, Kakol JM, Stein LD, Marth G, Sherry S, Mullikin JC, Mortimore BJ, Willey DL, Hunt SE, Cole CG, Coggill PC, Rice CM, Ning Z, Rogers J, Bentley DR, Kwok PY, Mardis ER, Yeh RT, Schultz B, Cook L, Davenport R, Dante M, Fulton L, Hillier L, Waterston RH, McPherson JD, Gilman B, Schaffner S, Van Etten WJ, Reich D, Higgins J, Daly MJ, Blumenstiel B, Baldwin J, Stange-Thomann N, Zody MC, Linton L, Lander ES, Altshuler D (fevereiro de 2001). «A map of human genome sequence variation containing 1.42 million single nucleotide polymorphisms». Nature. 409: 928–33. Bibcode:2001Natur.409..928S. PMID 11237013. doi:10.1038/35057149
- ↑ Carlson, Bruce (15 de junho de 2008). «SNPs — A Shortcut to Personalized Medicine». Mary Ann Liebert, Inc. Genetic Engineering & Biotechnology News. 28. Consultado em 6 de julho de 2008. Cópia arquivada em 26 de dezembro de 2010.
(subtitle) Medical applications are where the market's growth is expected
- ↑ Yu A, Li F, Xu W, Wang Z, Sun C, Han B, et al. (agosto de 2019). «Application of a high-resolution genetic map for chromosome-scale genome assembly and fine QTLs mapping of seed size and weight traits in castor bean». Scientific Reports. 9. 11950 páginas. Bibcode:2019NatSR...911950Y. PMC 6697702 . PMID 31420567. doi:10.1038/s41598-019-48492-8
- ↑ Thomas PE, Klinger R, Furlong LI, Hofmann-Apitius M, Friedrich CM (2011). «Challenges in the association of human single nucleotide polymorphism mentions with unique database identifiers». BMC Bioinformatics. 12 Suppl 4: S4. PMC 3194196 . PMID 21992066. doi:10.1186/1471-2105-12-S4-S4
- ↑ Goldstein JA (outubro de 2001). «Clinical relevance of genetic polymorphisms in the human CYP2C subfamily». British Journal of Clinical Pharmacology. 52: 349–55. PMC 2014584 . PMID 11678778. doi:10.1046/j.0306-5251.2001.01499.x
- ↑ Lee CR (julho–agosto de 2004). «CYP2C9 genotype as a predictor of drug disposition in humans». Methods and Findings in Experimental and Clinical Pharmacology. 26: 463–72. PMID 15349140
- ↑ Yanase K, Tsukahara S, Mitsuhashi J, Sugimoto Y (março de 2006). «Functional SNPs of the breast cancer resistance protein-therapeutic effects and inhibitor development». Cancer Letters. 234: 73–80. PMID 16303243. doi:10.1016/j.canlet.2005.04.039
- ↑ Fareed M, Afzal M (abril de 2013). «Single-nucleotide polymorphism in genome-wide association of human population: A tool for broad spectrum service». Egyptian Journal of Medical Human Genetics. 14: 123–134. doi:10.1016/j.ejmhg.2012.08.001
- ↑ a b Pui-Yan Kwok, Xiangning Chen (2003). «Detection of Single Nucleotide Polymorphisms» (PDF). Curr. Issues Mol. Biol.
- ↑ Adam D. Leache, Jamie R. Oaks (2017). «The Utility of Single Nucleotide Polymorphism (SNP) Data in Phylogenetics». Annual Review of Ecology, Evolution, and Systematics
- ↑ «Clustered RefSNPs (rs) and Other Data Computed in House». SNP FAQ Archive. Bethesda (MD): U.S. National Center for Biotechnology Information. 2005
- ↑ J.T. Den Dunnen (20 de fevereiro de 2008). «Recommendations for the description of sequence variants». Human Genome Variation Society. Consultado em 5 de setembro de 2008. Cópia arquivada em 14 de setembro de 2008
- ↑ den Dunnen JT, Antonarakis SE (2000). «Mutation nomenclature extensions and suggestions to describe complex mutations: a discussion». Human Mutation. 15: 7–12. PMID 10612815. doi:10.1002/(SICI)1098-1004(200001)15:1<7::AID-HUMU4>3.0.CO;2-N
- ↑ Ogino S, Gulley ML, den Dunnen JT, Wilson RB (fevereiro de 2007). «Standard mutation nomenclature in molecular diagnostics: practical and educational challenges». The Journal of Molecular Diagnostics. 9: 1–6. PMC 1867422 . PMID 17251329. doi:10.2353/jmoldx.2007.060081
- ↑ «Sequence Variant Nomenclature». varnomen.hgvs.org. Consultado em 2 de dezembro de 2019
- ↑ Johnson, Andrew D. (Outubro de 2009). «SNP bioinformatics: a comprehensive review of resources». Circulation: Cardiovascular Genetics. 2: 530–536. ISSN 1942-325X. PMC 2789466 . PMID 20031630. doi:10.1161/CIRCGENETICS.109.872010
- ↑ Malhis N, Jones SJ, Gsponer J (abril de 2019). «Improved measures for evolutionary conservation that exploit taxonomy distances». Nature Communications. 10. 1556 páginas. Bibcode:2019NatCo..10.1556M. PMC 6450959 . PMID 30952844. doi:10.1038/s41467-019-09583-2
- ↑ Nawar Malhis; Matthew Jacobson; Steven J. M. Jones; Jörg Gsponer (2020). «LIST-S2: Taxonomy Based Sorting of Deleterious Missense Mutations Across Species». Nucleic Acids Research. 48: W154–W161. PMC 7319545 . PMID 32352516. doi:10.1093/nar/gkaa288
- ↑ «View of SNPViz - Visualization of SNPs in proteins». genomicscomputbiol.org (em inglês). Consultado em 20 de outubro de 2018
- ↑ Ofoegbu TC, David A, Kelley LA, Mezulis S, Islam SA, Mersmann SF, et al. (junho de 2019). «PhyreRisk: A Dynamic Web Application to Bridge Genomics, Proteomics and 3D Structural Data to Guide Interpretation of Human Genetic Variants». Journal of Molecular Biology. 431: 2460–2466. PMC 6597944 . PMID 31075275. doi:10.1016/j.jmb.2019.04.043
- ↑ Ittisoponpisan S, Islam SA, Khanna T, Alhuzimi E, David A, Sternberg MJ (maio de 2019). «Can Predicted Protein 3D Structures Provide Reliable Insights into whether Missense Variants Are Disease Associated?». Journal of Molecular Biology. 431: 2197–2212. PMC 6544567 . PMID 30995449. doi:10.1016/j.jmb.2019.04.009