Sulfato de vanadila
O sulfato de oxovanádio(IV), conhecido também pelo nome mais comum sulfato de vanadila, é um sal do elemento vanádio com a fórmula química VOSO
4
. Esse composto higroscópico de cor azul-escura é encontrado mais comumente na forma hidratada, com vários graus de hidratação: VOSO
4•xH
2O
, onde 0 ≤ x ≤ 6. O pentahidrato VOSO
4
•5H
2O
é uma forma comum. Este composto é uma das fontes mais comuns de vanádio no laboratório, refletindo sua alta estabilidade. Ele apresenta o íon vanadila, VO2+
, que foi chamado de "íon diatômico mais estável".[1]
| Sulfato de vanadila Alerta sobre risco à saúde | |
|---|---|
| |

| |
| Nome IUPAC | Sulfato de oxovanádio(IV) |
| Outros nomes | Sulfato básico de vanádio (IV) óxido-sulfato de vanádio(IV) Oxissulfato de vanádio(IV) |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número RTECS | YW1925000 |
| Propriedades | |
| Fórmula química | H10O10SV |
| Massa molar | 253.03 g mol-1 |
| Aparência | Sólido azul |
| Ponto de fusão |
105 °C, 378 K, 221 °F |
| Solubilidade em água | Solúvel |
| Riscos associados | |
| Principais riscos associados |
Irritante |
| Ponto de fulgor | Não-inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | Cloreto de vanadila Nitrato de vanadila |
| Outros catiões/cátions | Sulfato de vanádio(III) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

O sulfato de vanadila é um intermediário na extração de vanádio de resíduos de petróleo, uma fonte comercial de vanádio.[2]
Síntese, Estrutura e Reações
editarO sulfato de vanadila é mais comumente obtido pela redução do pentóxido de vanádio com dióxido de enxofre:
- V
2O
5 + 7H
2O + SO
2 + H
2SO
4 → 2[VO(H
2O)
4]SO
4
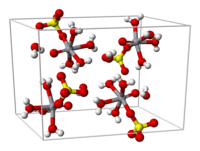
Da solução aquosa, o sal cristaliza como o penta-hidrato; a quinta água não está ligada ao metal no composto sólido. Visto como um complexo de coordenação, o íon é octaédrico, com um ligante oxo, quatro ligantes de água equatorial e um ligante sulfato monodentado.[1][3] O tri-hidrato também foi examinado por cristalografia.[4] Um hexa-hidrato existe abaixo de 13,6°C (286,8 K).[5] Dois polimorfos de VOSO
4
anidro são conhecidos.[6]
A distância da ligação V=O é 160 pm, cerca de 50 pm mais curta que as ligações V–OH
2
. Em solução, o íon sulfato dissocia-se rapidamente.
Sendo amplamente disponível, o sulfato de vanadila é um precursor comum de outros derivados de vanádio, como o acetilacetonato de vanadila:[7]
- [VO(H
2O)
4]SO
4 + 2 C
5H
8O
2 + Na
2CO
3 → [VO(C
5H
7O
2)
2] + Na
2SO
4 + 5H
2O + CO
2''";
Em solução ácida, a oxidação do sulfato de vanadila produz derivados de vanádio(V) de coloração amarela. A redução, por exemplo, por zinco, produz derivados de vanádio(III) e vanádio(II), que são caracteristicamente verdes e violetas, respectivamente.
Pesquisa médica
editarO sulfato de vanadila é um componente de suplementos alimentares e medicamentos experimentais. O sulfato de vanadila exibe efeitos semelhantes aos da insulina.[8]
O sulfato de vanadila tem sido extensivamente estudado no campo da pesquisa sobre diabetes como um meio potencial de aumentar a sensibilidade à insulina . Nenhuma evidência indica que a suplementação oral de vanádio melhora o controle glicêmico.[9][10] O tratamento com vanádio geralmente resulta em efeitos colaterais gastrointestinais, principalmente diarreia .
O sulfato de vanadila também é comercializado como um suplemento de saúde, geralmente para fisiculturismo. Deficiências em vanádio resultam em crescimento reduzido em ratos.[11] Sua eficácia para fisiculturismo não foi comprovada; algumas evidências sugerem que os atletas que o tomam estão apenas experimentando um efeito placebo.[12]
Ocorrência natural
editarComo a maioria dos sulfatos solúveis em água, o sulfato de vanadila raramente é encontrado na natureza. A forma anidra é a pauflerita,[13] um mineral de origem fumarólica . As formas hidratadas, também raras, incluem hexahidrato (stanleyita), pentahidratos (minasragrita, ortominasragrita,[14] e anortominasragrita) e trihidrato - bobjonesita.[15]
Referências
- ↑ a b Greenwood, Norman Neill; Earnshaw, Alan (1984). Chemistry of the Elements (em inglês). [S.l.]: Elsevier Science & Technology. p. 1157. ISBN 3-527-30673-0. doi:10.1002/14356007.a27_367
- ↑ Günter Bauer; Volker Güther; Hans Hess; Andreas Otto; Oskar Roidl; Heinz Roller; Siegfried Sattelberger (2005). «Vanadium and Vanadium Compounds». Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3-527-30673-0. doi:10.1002/14356007.a27_367
- ↑ Tachez, M.; Theobald, F.R. (1980). «Structure du Sulfate de Vanadyle Pentahydrate VO(H2O)5SO4 beta (variete orthorhombique)». Acta Crystallographica B. B36 (8): 1757–p1761. Bibcode:1980AcCrB..36.1757T. doi:10.1107/S0567740880007170
- ↑ Tachez, M.; Theobald, F. R. (1980). «Liaisons hydrogene dans les cristaux de sulfate de vanadyle trihydrate VOSO4(H2O)3: Comparaison structurale de quatre sulfates de vanadyle hydrate». Acta Crystallographica B. 36 (12): 2873–2880. Bibcode:1980AcCrB..36.2873T. doi:10.1107/S056774088001045X
- ↑ M. Tachez, F. Theobald, G. Trouillot. Crystal data for vanadyl sulphate hexahydrate VOSO4.6H2O. J. Appl. Crystallogr. (1976). 9, 246
- ↑ Boghosian, S.; Eriksen, K.M.; Fehrmann, R.; Nielsen, K. (1995). «Synthesis, Crystal Structure Redetermination and Vibrational Spectra of beta- VOSO4». Acta Chemica Scandinavica. 49: 703–708. doi:10.3891/acta.chem.scand.49-0703 Longo, J. M.; Arnott, R. J. (1970). «Structure and magnetic properties of VOSO4». Journal of Solid State Chemistry. 1 (3–4): 394–p398. Bibcode:1970JSSCh...1..394L. doi:10.1016/0022-4596(70)90121-0
- ↑ Bryant, Burl E.; Fernelius, W. Conard (1957), «Vanadium(IV) Oxy(acetylacetonate)», Inorganic Syntheses, ISBN 978-0-470-13236-4, 5, pp. 113–16, doi:10.1002/9780470132364.ch30
- ↑ Crans, D. C.; Trujillo, A. M.; Pharazyn, P. S.; Cohen, M. D. (2011). «How environment affects drug activity: Localization, compartmentalization and reactions of a vanadium insulin-enhancing compound, dipicolinatooxovanadium(V)». Coord. Chem. Rev. 255 (19–20): 2178–2192. doi:10.1016/j.ccr.2011.01.032
- ↑ Yeh, Gloria Y.; Eisenberg, David M.; Kaptchuk, Ted J.; Phillips, Russell S. (2003). «Systematic Review of Herbs and Dietary Supplements for Glycemic Control in Diabetes». Diabetes Care. 26 (4): 1277–1294. PMID 12663610. doi:10.2337/diacare.26.4.1277
- ↑ Smith, D.M.; Pickering, R.M.; Lewith, G.T. (31 de janeiro de 2008). «A systematic review of vanadium oral supplements for glycaemic control in type 2 diabetes mellitus». QJM. 101 (5): 351–358. PMID 18319296. doi:10.1093/qjmed/hcn003
- ↑ Schwarz, Klaus; Milne, David B. (1971). «Growth Effects of Vanadium in the Rat». Science. 174 (4007): 426–428. Bibcode:1971Sci...174..426S. JSTOR 1731776. PMID 5112000. doi:10.1126/science.174.4007.426
- ↑ Talbott, Shawn M.; Hughes, Kerry (2007). «Vanadium». The Health Professional's Guide to Dietary Supplements. [S.l.]: Lippincott Williams & Wilkins. pp. 419–422. ISBN 978-0-7817-4672-4
- ↑ Krivovichev, S. V.; Vergasova, L. P.; Britvin, S. N.; Filatov, S. K.; Kahlenberg, V.; Ananiev, V. V. (1 de agosto de 2007). «Pauflerite, -VO(SO4), a New Mineral Species from the Tolbachik Volcano, Kamchatka Peninsula, Russia». The Canadian Mineralogist. 45 (4): 921–927. Bibcode:2007CaMin..45..921K. doi:10.2113/gscanmin.45.4.921
- ↑ Hawthorne, F. C.; Schindler, M.; Grice, J. D.; Haynes, P. (1 de outubro de 2001). «Orthominasragrite, V4+O(SO4)(H2O)5, A New Mineral Species from Temple Mountain, Emery County, Utah, U.A.A.». The Canadian Mineralogist. 39 (5): 1325–1331. Bibcode:2001CaMin..39.1325H. doi:10.2113/gscanmin.39.5.1325
- ↑ Schindler, M.; Hawthorne, F. C.; Huminicki, D. M.C.; Haynes, P.; Grice, J. D.; Evans, H. T. (1 de fevereiro de 2003). «Bobjonesite, V4+ O (So4) (H2O)3, A New Mineral Species from Temple Mountain, Emery County, Utah, U.s.a.». The Canadian Mineralogist. 41 (1): 83–90. Bibcode:2003CaMin..41...83S. doi:10.2113/gscanmin.41.1.83