Metilona
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
| Metilona Alerta sobre risco à saúde | |
|---|---|
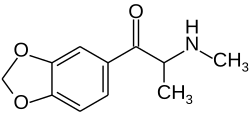
| |
| Nome IUPAC | 1- (1,3-benzodioxol-5-il) -2- (metilamino) propan-1-ona; clorhidrato |
| Outros nomes | βk-MDMA; MDMC. |
| Identificadores | |
| Abreviação | M1 |
| Número CAS | |
| PubChem | |
| DrugBank | DB12833 |
| ChemSpider | |
| Código ATC | N06 |
| SMILES |
|
| Propriedades | |
| Fórmula química | C11H13NO3 |
| Massa molar | 207.21 g mol-1 |
| Farmacologia | |
| Via(s) de administração | oral, intranasal, intravenosa, intramuscular, retal |
| Classificação legal |
Lista de substâncias sujeitas a controle especial - Lista F2 (BR)
|
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Metilona (3,4-metilenodioxi-N-metilcatinona, MDMC ou βk-MDMA) é uma droga psicoativa com propriedades empatógenas e estimulantes. É membro das classes de anfetaminas substituídas, catinonas substituídas e metilenodioxifenetilaminas substituídas.
Metilona é o análogo de catinona substituída do MDMA e o análogo 3,4-metilenodioxi da metacininona. A única diferença estrutural da metilona em relação ao MDMA é a substituição de 2 átomos de hidrogênio por 1 átomo de oxigênio na posição β do núcleo da feniletilamina, formando um grupo cetona.[1]
A metilona foi sintetizada pela primeira vez pelos químicos Peyton Jacob III e Alexander Shulgin, em 1996, para potencial uso como antidepressivo.[2]
Efeitos
editarSemelhanças com o MDMA
editarUm estudo examinou as diferenças entre as catinonas substituídas e MDMA em ratos treinados para discriminar MDMA de soro fisiológico. A metilona não substitui a anfetamina em animais treinados para diferenciar essa droga da solução salina (placebo).[3] Além disso, do mesmo modo como o MDMA, a metilona atua nos sistemas monoaminérgicos. In vitro, a metilona possui um terço da potência do MDMA na inibição do acúmulo de serotonina plaquetária e aproximadamente o mesmo em seus efeitos inibidores nos transportadores de dopamina e noradrenalina.[4][5][1]
Apesar dessas semelhanças comportamentais e farmacológicas entre a metilona e o MDMA, os efeitos subjetivos observados de ambas as drogas não são completamente idênticos. Alexander Shulgin escreveu sobre o primeiro:,[6]
“[Metilona] tem quase a mesma potência do MDMA, mas não produz os mesmos efeitos. Tem uma ação quase antidepressiva, agradável e positiva, mas não tem a mágica única do MDMA”.
Farmacologia
editarFarmacodinâmica
editarA metilona atua como um inibidor misto da recaptação de serotonina, noradrenalina e dopamina.[1][7] Em comparação com o MDMA, possui uma afinidade aproximadamente três vezes mais baixa com o transportador de serotonina, enquanto sua afinidade para os transportadores de noradrenalina e dopamina é semelhante. A afinidade da metilona com o transportador de monoamina vesicular 2 (VMAT2) é cerca de 13 vezes menor que a do MDMA. Os resultados dessas diferenças na farmacologia em relação ao MDMA são que a metilona é menos potente em termos de dosagem, tem efeitos catecolaminérgicos mais equilibrados em relação aos receptores serotoninérgicos e se comporta mais como um inibidor de recaptação, tal qual o metilfenidato, do que como um liberador, como a anfetamina. No entanto, a metilona possui capacidades de liberação relativamente potentes, talvez devido à sua capacidade de fosforilar os transportadores de monoamina.
Farmacocinética
editarAs duas principais vias metabólicas em mamíferos para a metilona são a N-desmetilação para methylenedioxycathinone (MDC), e desmetilação seguida por O-metilação do 3- ou 4-hidroxi grupo do 4-hidroxi-3-methoxymethcathinone (HMMC) ou 3-hidroxi -4-metoximetecatinona (3-OH-4-MeO-MC). Quando 5 mg/kg de metilona foi administrada a ratos, verificou-se que cerca de 26% foi excretado como HMMC nas primeiras 48 horas (menos de 3% foi excretado na forma inalterada).[8]
Legalidade
editarBrasil
editarÉ uma substância incluída na Lista F2 pela Anvisa. É uma droga ilegal.[9]
Países Baixos
editarNos Países Baixos, a metilona ainda não está listada na Lei do Ópio, mas está coberta pela Lei dos Medicamentos. Como a metilona não é registrada oficialmente, é proibido comercializar a metilona. O Ministro da Saúde solicitou ao Grupo de Avaliação e Monitoramento de Novos Medicamentos do Ponto de Coordenação (CAM) a coleta de informações sobre esta substância, resultando possivelmente em uma avaliação de risco oficial.[10] Até agora, nenhuma pesquisa foi conduzida sobre a toxicidade da metilona, portanto, pouco se sabe sobre a nocividade da droga.
Nova Zelândia
editarNa Nova Zelândia, embora a metilona não seja explicitamente programada e esteja fora das definições estritas de um "análogo da anfetamina" na Lei do Uso Indevido de Drogas, ela é considerada "substancialmente semelhante" à metacatinona e, portanto, considerada pelas autoridades policiais como sendo uma droga ilegal de classe C. Metilona foi vendida na Nova Zelândia por cerca de 6 meses de novembro de 2005 a abril de 2006 como um substituto do MDMA, sob o nome de "Ease". O produto foi retirado após disputas judiciais com o governo.[11][12]
Reino Unido
editarNo Reino Unido, a metilona é ilegal desde a revisão de 16/04/2010 da lei do uso indevido de drogas. Antes Em março de 2010, foram anunciados planos para fabricar metilona e outras catinonas, drogas de Classe B, "dentro de semanas". A importação dos compostos foi proibida.[13]
Estados Unidos
editarEm 21 de outubro de 2011, a DEA emitiu uma nota de proibição sobre a metilona. É ilegal possuir e distribuir a substância.[14][15]
Ver também
editarReferências
- ↑ a b c Cozzi NV, Sievert MK, Shulgin AT, Jacob P, Ruoho AE. «Inhibition of plasma membrane monoamine transporters by beta-ketoamphetamines». European Journal of Pharmacology. 381: 63–9. PMID 10528135. doi:10.1016/S0014-2999(99)00538-5
- ↑ WO 9639133
- ↑ TA Dal Cason, R Young, RA Glennon. Cathinone: an investigation of several N-alkyl and methylenedioxy-substituted analogs. Pharmacol. Biochem. Behav. 58, 1109–1116 (1997)
- ↑ NV Cozzi, MK Sievert, AT Shulgin, P Jacob III, AE Ruoho. Methcathinone and 2 methylamino-1-(3,4-methylenedioxyphenyl)propan-1-one (methylone) selectively inhibit plasma membrane catecholamine reuptake transporters. Soc. Neurosci. Abs., 24, 341.8 (1998).
- ↑ NV Cozzi, AT Shulgin, AE Ruoho. Methcathinone (MCAT) and 2-methylamino-1-(3,4 methylenedioxyphenyl)propan-1-one (MDMCAT) inhibit [3H]serotonin uptake into human platelets. Amer. Chem. Soc. Div. Med. Chem. Abs., 215, 152 (1998).
- ↑ «Cathinone | Ask Dr. Shulgin Online». Consultado em 17 de janeiro de 2010. Cópia arquivada em 13 de abril de 2010
- ↑ Nagai F, Nonaka R, Satoh Hisashi Kamimura K. «The effects of non-medically used psychoactive drugs on monoamine neurotransmission in rat brain». European Journal of Pharmacology. 559: 132–7. PMID 17223101. doi:10.1016/j.ejphar.2006.11.075
- ↑ Xenobioica.[ligação inativa] HT Kamata, N Shima, K Zaitsu, T Kamata, A Miki, M Nishikawa, M Katagi, H Tsuchihashi. (2006). Metabolism of methylone in humans and rats. Volume 36, Number 8 / August 2006.
- ↑ «Anvisa inclui 21 substâncias em lista de drogas proibidas - Notícias». portal.anvisa.gov.br. Consultado em 9 de agosto de 2020
- ↑ van Amsterdam et al., 2004
- ↑ «Party pill sparks official concern». One News. 7 de abril de 2006. Consultado em 23 de outubro de 2011. Cópia arquivada em 9 de fevereiro de 2012
- ↑ "EASE trial terminated after conflicting advice," Arquivado em 2012-09-29 no Wayback Machine scoop.co.nz (9 de abril de 2006).
- ↑ «Suspected mephedrone-type compound seized at airport». BBC News. 1 de abril de 2010. Consultado em 3 de abril de 2010
- ↑ «Chemicals Used in 'Bath Salts' Now Under Federal Control and Regulation». USA Dept of Justice. Consultado em 22 de abril de 2014. Cópia arquivada em 25 de abril de 2014
- ↑ «Schedules of Controlled Substances: Placement of Methylone Into Schedule I». Consultado em 22 de abril de 2014. Cópia arquivada em 17 de abril de 2014