Sal vermelho de Roussin
| Sal Vermelho de Roussin Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Nome IUPAC | tetranitrosil-di-μ-sulfidodiferrato(Fe–Fe)(2–) de potássio |
| Outros nomes | Tetranitrosildi-mu-tioxodi-,(Fe-Fe),ferrato(2-) de potássio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | Fe2N4K2O4S2 |
| Massa molar | 374.04 g/mol |
| Aparência | Cristais vermelho-escuros em forma de agulhas ou prismas losangulares oblíquos, fotossensíveis |
| Ponto de fusão |
Decompõe |
| Solubilidade | Água, etanol, metanol, ácido acético, muito solúvel em éter; ligeiramente solúvel em hexano; praticamente insolúvel em clorofórmio e CS2. |
| Estrutura | |
| Estrutura cristalina | Monoclínico |
| Compostos relacionados | |
| Outros aniões/ânions | Sal preto de Roussin Nitroprussiato de sódio Pentacarbonil de ferro Clusters de ferro-enxofre Ésteres de Roussin |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O sal vermelho de Roussin ou tetranitrosil-di-μ-sulfidodiferrato(Fe-Fe)(2–) de potássio é o composto inorgânico com a fórmula química K2[Fe2S2(NO)4]. Este complexo de nitrosila metálica foi descrito pela primeira vez pelo químico francês Zacharie Roussin em 1858, tornando-o um dos primeiros aglomerados sintéticos de ferro-enxofre produzidos.[1][2] O termo "sal vermelho de Roussin" geralmente se refere ao sal de potássio, embora outros sais do mesmo ânion complexo também possam ser referidos como "sais vermelhos de Roussin".
Estrutura e Ligação
editar
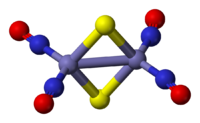
O ânion do sal vermelho de Roussin é um bitetraedro com borda compartilhada, em que um par de unidades de Fe(NO)2 são ligadas por um par de ligantes de sulfeto. As ligações Fe-NO são lineares, indicando que o NO está agindo como um doador de três elétrons.[3] O composto diamagnético obedece à regra dos 18 elétrons. A cor vermelha escura do complexo é atribuída a uma série de interações de transferência de carga entre o íon de ferro e os ligantes nitrosila.[4]
O complexo possui uma estrutura um tanto incomum, contendo uma ligação covalente direta entre os dois átomos de ferro, que está apresentando um estado de oxidação incomum de -1 neste complexo. Todos os elétrons estão emparelhados, tornando esse composto diamagnético.
A razão desse estado de oxidação tão incomum se deve à ligação covalente entre os átomos de Fe e principalmente pelo modo de ligação entre o ferro e os grupos nitrosila (NO), que formam um tipo de complexo conhecido como complexo de retrodoação pi ou backbonding,[5] nos quais, além da ligação coordenada do ligante para o íon metálico, também há uma ligação pi secundária, mais fraca, do metal para o ligante.[6] Tal situação tende a estabilizar o íon metálico em estados de oxidação mais baixos, por vezes incomuns para o elemento em questão. Ligantes do tipo incluem o monóxido de carbono, monóxido de nitrogênio / nitrosônio (NO+), cianeto, isocianetos, fosfinas, entre outros. O íon NO+ se liga aos centros metálicos de um modo semelhante ao CO, uma vez que ambos os ligantes são isoeletrônicos. No entanto, o NO neutro possui um elétron a mais do que o CO. Ao se ligar ao centro de ferro neste complexo, o grupo NO assume uma confirmação linear, o que confirma que ele está presente como o íon NO+. Para tal, o NO neutro precisa "empurrar" seu elétron extra para o átomo do metal, forçando-o a assumir um estado de oxidação uma unidade mais baixo do que o metal teria se estivesse ligado a CO ou a NO+ (no caso deste composto especificamente, esse estado de oxidação acaba se tornando negativo). São conhecidos também outros complexos nitrosílicos como o [Fe(CO)2(NO)2] no qual o Fe possui nox -2.
Síntese
editarO químico francês Z. Roussin[1] preparou este sal pela primeira vez enquanto investigava as reações entre o íon nitroprussiato ([Fe(CN)5NO]2−) e o enxofre.[7][8]
Conforme descrito pelo próprio Z. Roussin, este composto pode ser preparado a partir da mistura de uma solução de sulfeto solúvel (como sulfetos de sódio, potássio e amônio) com nitrito de potássio, seguida da adição lenta e cuidadosa de uma solução de um sal de ferro (como FeCl3 ou FeSO4) gota a gota sob intensa agitação. Um precipitado preto de FeS se desenvolve, o qual, após ebulição da mistura por vários minutos, irá se dissolver com a formação do sal vermelho de Roussin.[7]
O sal também pode ser preparado pela reação de sais de sulfeto com haletos de nitrosila de ferro: [8]
- [Fe2I2(NO)4] + 2K2S → K2[Fe2S2(NO)4] + 2KI
Outra forma de obter o sal vermelho de Roussin é alcalinizar uma solução do composto relacionado sal preto de Roussin, NH4[Fe4S3(NO)7], usando uma base adequada:
- 2NH4[Fe4S3(NO)7] + 6KOH → 3K2[Fe2S2(NO)4] + 2Fe(OH)2 + 2NH4OH + 2NO
Outro procedimento de obtenção (no caso, do sal de sódio relacionado) consiste em reagir nitrito de sódio, ácido ascórbico, sulfato ferroso, sulfeto de sódio e hidróxido de sódio nesta ordem. O ácido ascórbico atua tanto como acidulante quanto como agente redutor, convertendo o nitrito em ácido nitroso e depois reduzindo-o a monóxido de nitrogênio, que então se ligará aos íons de ferro formando complexos nitrosila, que reagirão com o sulfeto em meio básico dando o sal vermelho de Roussin.[carece de fontes]
- 2FeSO4 + 4HNO2 + 3C6H8O6 + 2Na2S + 2NaOH → Na2[Fe2S2(NO)4] + 3C6H6O6 + 2Na2SO4 + 6H2O
Para obter os “ésteres”, o sal é alquilado:
- [K2Fe2S2(NO)4] + 2 R–X → [Fe2(S–R)2(NO)4] + 2KX
Os "ésteres" também podem ser facilmente preparados a partir da reação do [Fe2I2(NO)4] com um tiol ou com um composto tal como o tiossulfato.
- [Fe2I2(NO)4] + 2R–S-Na+ → [Fe2(R–S)2(NO)4] + 2NaI
O sal vermelho de Roussin de potássio é um composto de cor vermelha escura, por vezes quase preta no estado sólido, com um certo brilho metálico, assemelhando-se um pouco ao iodo. Cristaliza na forma de agulhas ou de cristais prismáticos oblíquos em forma de losango (monoclínicos), os quais são bastante densos. É moderadamente solúvel em água à temperatura ambiente, sendo mais solúvel em água quente e menos em água fria, da qual pode cristalizar. É termicamente estável até cerca de 115°C, quando começa a se decompor liberando NO, FeS e outros compostos. Também é fotossensível, sofrendo decomposição por exposição à luz, especialmente quando dissolvido. Também é descrito como tendo um sabor um tanto amargo.
O sal vermelho de Roussin é muito solúvel em etanol, metanol, ácido acético glacial, álcool amílico e especialmente em éter dietílico, e ligeiramente solúvel em solventes hidrocarbonetos, como o hexano. É praticamente insolúvel em clorofórmio e dissulfeto de carbono, a menos que estes contenham éter etílico ou etanol.
O composto é estável em solução básica, mas rapidamente se decompõe em solução ácida, formando o sal preto em meio levemente ácido, ou sendo completamente decomposto em um sal de ferro, H2S e NO na presença de ácidos fortes. [7]
Fotossensibilidade
editarO sal vermelho de Roussin é fotossensível, sofrendo decomposição quando exposto à luz, produzindo o sal preto de Roussin e liberando NO gasoso.
Na ausência de ar, a reação é reversível, com o monóxido de nitrogênio recombinando com o sal negro para reformar o sal vermelho. No entanto, na presença do oxigênio do ar, o NO é oxidado a NO2, tornando a reação irreversível.
Tratando-se o sal preto com base, também se regenera o sal vermelho, com precipitação de alguns hidróxidos de ferro.
Ocorrência e aplicações potenciais
editarÉ encontrado na natureza como seus “ésteres” com a fórmula [Fe2(S-R)2(NO)4], onde “R” é qualquer grupo alquil.[3] Tais compostos se formam a partir da reação do monóxido de nitrogênio produzido biologicamente e os clusters de ferro-enxofre presentes em algumas proteínas e enzimas.[9] Além disso, o sal vermelho de Roussin é discutido nas áreas de microbiologia e ciência de alimentos devido às suas propriedades mutagênicas.[10]
O sal vermelho de Roussin e compostos relacionados (como os "ésteres de Roussin" e o sal preto de Roussin) despertam bastante interesse na comunidade científica devido às suas propriedades. Estas compostos possuem estruturas semelhantes aos clusters de ferro-enxofre encontrados em muitas proteínas e enzimas importantes que efetuam reações redox nos organismos. Exemplos de tais proteínas de ferro-enxofre incluem as ferredoxinas, importantes transportadores de elétrons na fotossíntese, e a nitrogenase, uma enzima envolvida na fixação do nitrogênio em certas bactérias. Devido a isso, esses sais foram avaliados como modelos para esses complexos das enzimas.[11] Além disso, o sal vermelho de Roussin é discutido nos campos de microbiologia e seu uso potencial na conservação de alimentos, devido às suas propriedades antibacterianas e por ser praticamente não-tóxico.
Os derivados ésteres estão sendo investigados como doadores de óxido nítrico em biologia e medicina, devido à toxicidade relativamente baixa e boa estabilidade do sal vermelho de Roussin.[12] A fotodissociação do composto induz a liberação de NO, sensibilizando assim as células-alvo à exposição à radiação.[10]
Ver também
editarReferências
editar- ↑ a b Butler, Anthony R. (julho de 1982). «The chemist Z. Roussin (1827-94)». Journal of Chemical Education. 59 (7). 549 páginas. Bibcode:1982JChEd..59..549B. doi:10.1021/ed059p549
- ↑ Roussin, M. L. (1858). «Recherches sur les nitrosulfures doubles de fer (nouvelle classe de sels)». Ann. Chim. Phys. 52: 285–303
- ↑ a b Thomas, J. T.; Robertson, J. H.; Cox, E. G. (1 de setembro de 1958). «The crystal structure of Roussin's red ethyl ester». Acta Crystallographica. 11 (9): 599–604. doi:10.1107/S0365110X58001602
- ↑ Jaworska, Maria; Stasicka, Zofia (2005). «Structure and UV-Vis spectroscopy of the iron-sulfur dinuclear nitrosyl complexes [Fe2S2(NO)4]2− and [Fe2(SR)2(NO)4]». New Journal of Chemistry. 29 (4). 604 páginas. doi:10.1039/B409519G
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (em inglês) 2ª ed. [S.l.]: Butterworth-Heinemann. ISBN 978-0-08-037941-8
- ↑ https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Book%3A_Introduction_to_Inorganic_Chemistry_(Wikibook)/05%3A_Coordination_Chemistry_and_Crystal_Field_Theory/5.05%3A_-Bonding_between_Metals_and_Ligands
- ↑ a b c d Hans Reihlen, Adolf v. Friedolsheim (1927). «Über komplexe Stickoxydverbindungen und das sogenannte einwertige Eisen». Justus Liebigs Annalen der Chemie. 457: 71–82. doi:10.1002/jlac.19274570103
- ↑ a b TB Rauchfuss; TD Weatherill (1982). «Roussin's Red Salt revisited: reactivity of Fe2 (μ-E) 2 (NO) 42-(E= S, Se, Te) and related». Inorganic Chemistry. 21 (2): 827–830. doi:10.1021/ic00132a071
- ↑ https://pubs.rsc.org/en/content/articlelanding/2019/dt/c9dt00924h
- ↑ a b Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Fitzpatrick, Jessica; Kim, Eunsuk (18 de ago. de 2015). «Synthetic modeling chemistry of iron-sulfur clusters in nitric oxide signaling». Accounts of Chemical Research. 48 (8): 2453–2461. PMID 26197209. doi:10.1021/acs.accounts.5b00246 – via PubMed
- ↑ Yoon, H.; Park, S.; Lim, M. (2020). «Photorelease Dynamics of Nitric Oxide from Cysteine-Bound Roussin's Red Ester». The Journal of Physical Chemistry Letters. 11 (9): 3198–3202. PMID 32250631. doi:10.1021/acs.jpclett.0c00739